En el Apéndice 3 de Constantes físicas y numéricas se proporcionan los datos correspondientes con su máximo número de cifras significativas.
Electronvolt
En física atómica y nuclear las energías también se suelen medir en una unidad más apropiada. Concretamente el "electronvolt" eV , que es la energía cinética que adquiere un electrón en el vacío al ser acelerado por una diferencia de potencial de 1 Volt.
Se recordará que, en electricidad, la diferencia de potencial eléctrico, ' V', entre dos puntos se define como el trabajo necesario, ' W', para transportar la unidad de carga positiva en la región considerada. Por lo que si el valor de la carga es ' q ' : V = W/q y por ello W = q·V
Por consiguiente, la energía necesaria para transportar la carga, igual al referido trabajo, puede venir expresada por el producto de una diferencia de potencial por una carga y, por tanto:
1 coulomb · 1 volt = 1 joule.
En el caso que nos ocupa, con el módulo de la carga del electrón igual a 1,602·10 -19coulomb:
1 eV = 1,602·10 -19joule (J)
empleándose asimismo los múltiplos keV (10 3eV) y MeV (10 6eV).
Los niveles de energía de los electrones en la corteza atómica varían, en módulo, desde algunos eV para los más periféricos hasta un centenar de keV para los más internos, y por ello más fuertemente ligados, de los átomos más pesados.
Así por ejemplo, el nivel de energía de un electrón de la capa K del átomo de hidrógeno es de -13,60 eV y para el wolframio de -69,51 keV. En este último el nivel de energía fundamental de un electrón de la capa M es de -2,81 keV, por lo que una transición o 'caída' de un electrón de la capa M a un posible hueco generado en la capa K supondrá la emisión de -2,81 - (-69,51) = 66,7 keV de radiación electromagnética; en forma de fotón X, como se comentará en el apartado 3.3. Obsérvese que si se manejan energías de ionización, positivas, en vez de energías de enlace, es decir, 2,81 y 69,51 keV, el resultado es el mismo pero si se plantea adecuadamente el cómputo: son sus valores cambiados de signo los que realmente corresponden a las energías inicial o final: [-(2,81)] - [-(69,51)] = 66,7 keV.
Defecto de masa y energía de enlace
De acuerdo con la equivalencia masa-energía establecida por Einstein en la teoría de la relatividad, entre masa en reposo y energía existe una correspondencia dada por:
E = m·c 2
donde 'c' es la velocidad de la luz en el vacío, muy aproximadamente: c = 3·10 8m/s.
Por ejemplo, una masa de 1 uma , de transformarse por completo en energía, generaría:
E (1 uma) = (1 uma)·c 2= (1,6605·10 -27kg)·( 3·10 8m/s) 2= 1,494·10 -10joules = 931,5 Mev
resultado obtenido con todas las cifras exactas posibles de los datos intermedios y que proporciona el "equivalente energético de la unidad de masa atómica" , también recogido en el Apéndice 3 de Constantes físicas y numéricas con todos sus decimales exactos.
Esta equivalencia masa-energía es la que permite justificar la unión de los nucleones en el núcleo, a través de las fuerzas nucleares, cuyas propiedades se considerarán en el apartado 1.5. Porque, en efecto, si se suma la masa de todos los nucleones integrantes de un determinado núcleo, y el resultado se compara con la masa del núcleo una vez formado, se aprecia una ligera disminución, a la que se denomina "defecto de masa nuclear" : disminución de masa total experimentada por los nucleones constituyentes de un núcleo al pasar a conformar el núcleo final .
Así, si se considera un núcleo formado por Z protones y N neutrones, cuya masa es M(Z,N), siempre se cumple que:
M(Z,N) < Z·m p+ N·m n
y su defecto de masa vendrá dado por:
Δm = Z·m p+ N·m n– M (Z, N)
A este defecto de masa le corresponderá, por tanto, una energía:
ΔE =[Z·m p+ N·m n– M (Z, N)]·c 2
Se la denomina "energía de enlace nuclear" . Ya que al provenir de la masa desaparecida durante el proceso de constitución del núcleo, y haberse liberado durante el mismo, da cuenta de la unión o 'enlace' de sus nucleones: sería la que debería aportarse al núcleo para volver a descomponerlo en sus nucleones constituyentes.
Por supuesto que para los electrones corticales unidos al átomo existe también defecto de masa y, por ello, energía de enlace en el sentido comentado. Pero su magnitud es prácticamente despreciable frente a los valores nucleares, ya que la intensidad de las fuerzas eléctricas es mucho menor que para las fuerzas que actúan en el núcleo, como se comenta en el último apartado 1.5.
La escisión de núcleos pesados apropiados ('fisión nuclear'), o la unión de ligeros (fusión nuclear'), puede conducir a un balance final con disminución de masa en el proceso. Tal disminución se traducirá en la liberación de la correspondiente energía, que puede llegar a ser muy considerable y fundamenta los usos de la "energía nuclear".
1.4 NOMENCLATURA NUCLEAR
Núclidos: notación
En física nuclear se denomina "núclido" o nucleido a cada especie nuclear, esto es, a cada tipo de núcleo caracterizado por su número de protones y de neutrones.
La notación habitual empleada para designar los núclidos, o núcleos específicos, consiste en acompañar al símbolo químico del átomo al que corresponde el núcleo considerado con un subíndice indicativo de su número atómico Z y un superíndice igual a su número másico A, ambos normalmente a la izquierda del símbolo:
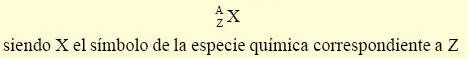
Por ejemplo 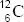 , ó
, ó 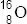 . Aunque con frecuencia, puesto que el símbolo químico ya conlleva implícitamente el conocimiento de Z, se obvia éste, indicando solo el valor de A: 12C ó 16O.
. Aunque con frecuencia, puesto que el símbolo químico ya conlleva implícitamente el conocimiento de Z, se obvia éste, indicando solo el valor de A: 12C ó 16O.
Actualmente se conocen en torno a 2000 núclidos diferentes, de entre los cuales unos 280 son formas estables de los elementos naturales. Los restantes son radiactivos. El concepto de radiactividad se revisa como complemento al final de este capítulo.
Isótopos
Los núclidos pueden presentar el mismo número atómico Z pero diferente número de neutrones N: corresponderán entonces a átomos con distinto número másico A pero con idénticas propiedades químicas por pertenecer al mismo elemento químico (sus cortezas electrónicas son las mismas aunque sus núcleos sean distintos). Definirán, por tanto, átomos que, por pertenecer a un mismo elemento químico, ocuparán el mismo lugar en la tabla periódica.
De ahí que a tales núcleos se les denomine "isótopos" (iso: igual, topo: lugar): núclidos con el mismo número atómico Z pero diferentes número de neutrones N y número másico A, cuyos átomos neutros presentan las mismas propiedades químicas . El término isótopo se extiende también a los átomos que contienen los núcleos isótopos en cuestión, cuyo conjunto constituye la "pléyade isotópica" del elemento químico considerado.
Ejemplos:
- los tres isótopos del hidrógeno: 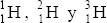 , todos ellos con 1 protón, pero los dos últimos con 1 o con 2 neutrones, respectivamente; de ahí sus denominaciones de deuterio (2 nucleones) y tritio (3 nucleones)
, todos ellos con 1 protón, pero los dos últimos con 1 o con 2 neutrones, respectivamente; de ahí sus denominaciones de deuterio (2 nucleones) y tritio (3 nucleones)
Читать дальше

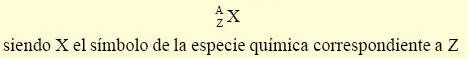
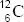 , ó
, ó 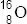 . Aunque con frecuencia, puesto que el símbolo químico ya conlleva implícitamente el conocimiento de Z, se obvia éste, indicando solo el valor de A: 12C ó 16O.
. Aunque con frecuencia, puesto que el símbolo químico ya conlleva implícitamente el conocimiento de Z, se obvia éste, indicando solo el valor de A: 12C ó 16O.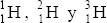 , todos ellos con 1 protón, pero los dos últimos con 1 o con 2 neutrones, respectivamente; de ahí sus denominaciones de deuterio (2 nucleones) y tritio (3 nucleones)
, todos ellos con 1 protón, pero los dos últimos con 1 o con 2 neutrones, respectivamente; de ahí sus denominaciones de deuterio (2 nucleones) y tritio (3 nucleones)










