A partir del segundo nivel de energía más próximo al núcleo, los niveles se desdoblan en dos o más subniveles, con el primer orbital similar en su distribución esférica al del nivel más profundo. Pero los restantes subniveles presentan distribuciones de probabilidad de formas más caprichosas, con las que la mecánica cuántica vuelve a sorprendernos a consecuencia de sus reglas de cuantización. Los conjuntos de subniveles se agrupan en capas, que se designan con las letras K, L, M, N, O, P y Q y se esquematizan habitualmente como refleja la Fig. 1.4 , prescindiendo de la complejidad de los orbitales siguientes al primero. Cada capa puede contener un número máximo de electrones igual a 2 n 2, donde nes el número ordinal de la capa respecto al núcleo (número cuántico "principal"): 1 para la K, 2 para la L, 3 para la M, etc. Por tanto la capa K podrán contener como máximo 2 electrones, 8 la L, 18 la M, etc.
Los subniveles, también denominados subcapas, vienen determinados por un segundo número cuántico ("orbital") del que depende la forma de la distribución de probabilidad del electrón. Los subniveles se designan sucesivamente, de núcleo a periferia, como s , p , d y f . Por tanto, son los primeros orbitales 's' de cada capa los que adoptan una distribución esférica con el núcleo como centro, tal como se ha señalado; pueden contener hasta 2 electrones. En los orbitales 'p' la distribución de carga se localiza en dos regiones cuasiesféricas simétricas al núcleo y que se sitúan en cada una de las tres direcciones del espacio; pueden contener hasta 6 electrones. Los orbitales 'd' y 'f' aún resultan más complicados y pueden contener hasta 10 y 14 electrones, respectivamente. Por tanto, son los orbitales 's' los que corresponden a la representación del esquema simplificado de capas de la Fig. 1.4 , o a la propia representación de la corteza atómica en la Fig. 1.3 .
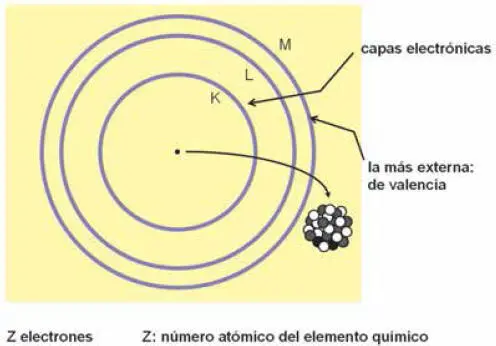
Figura 1.4 Esquema de las capas electrónicas de la corteza atómica. El núcleo realmente resulta irrepresentable a la misma escala.
Energías del electrón ligado
Los electrones, con carga negativa, se encuentran unidos al núcleo por la fuerza electrostática o culombiana que ejerce sobre ellos la carga positiva nuclear. La fuerza será, pues, muy intensa en las proximidades del núcleo e irá disminuyendo al aumentar el radio de la órbita. Y como en cualquier sistema ligado, la energía de enlace de los electrones (potencial por deberse a su estado o posición) será negativa, puesto que es una cantidad de energía que debe ser aportada para extraer al electrón fuera del átomo. Concretamente, su magnitud será igual al trabajo necesario para desligar al electrón del núcleo y llevarlo fuera del átomo, o "energía de ionización" . Así, la energía de ionización coincide con el módulo de la energía de enlace, es decir, con su valor pero positivo. Lo que, si bien es cómodo en muchas situaciones para referirse a la magnitud sin el 'lastre' del signo negativo, no debe confundir acerca de cuando se utiliza uno u otro concepto.
Consiguientemente, cada órbita corresponde a un determinado nivel de energía (de enlace) que aumenta, es decir, su valor negativo disminuye en módulo, conforme aumenta la distancia al núcleo. Al desplazarse hacia la periferia la separación energética entre las capas disminuye, tal como se observa en la Fig. 1.4 .
Estados fundamental y excitados
Los estados de menor energía (más negativa, por estar más ligados al núcleo) corresponden a aquellos en que la distancia promedio de los electrones al núcleo es menor. Se dice que un átomo se encuentra en su "estado fundamental" cuando sus electrones se sitúan, como cualquier sistema físico que busca el equilibrio, en sus posibles niveles de energía más bajos. Los restantes estados, de energía superior, corresponderán a "estados excitados" . Mediante una "excitación" , es decir, un aporte de energía externa al átomo, por ejemplo por elevación térmica, se podrá lograr que un electrón 'ascienda' desde una órbita permitida a otra también permitida pero menos enlazada. Y desde ella podrá volver a caer espontáneamente a la órbita inicial, como un objeto elevado a un estado de mayor energía potencial gravitatoria y dejado en libertad, que cae hasta otro estado de menor energía potencial. El electrón cede entonces la energía en exceso en forma de radiación electromagnética, como se comentará con más detalle en el apartado 2.4 del siguiente capítulo.
Si la excitación es tan elevada como para arrancar al electrón de la atracción nuclear, independizándolo del átomo, se produce una "ionización" : el átomo remanente es un ion , con una unidad de carga positiva, entendida como tal el módulo de la carga del electrón. Como se ha indicado, el trabajo requerido para el proceso se denomina "energía de ionización".
Pero conviene abundar aquí en la precaución apuntada antes acerca del manejo de los conceptos cuánticos. Es muy probable extraviarse al intentar imaginar el movimiento del electrón en sus órbitas, 'saltando' o 'cayendo' de una órbita a otra. Es más seguro, por no decir sencillo, ignorar al electrón y considerar al átomo como un todo. Es decir, pensar sólo en los estados de energía permitidos del átomo y no en un electrón saltando de una órbita a otra sino en el átomo experimentando una transición de un estado de energía a otro, por absorción o emisión de radiación electromagnética en cuantía igual a la diferencia de energías entre los estados inicial y final. En definitiva, considerar un 'átomo excitado' sin plantearse los avatares del electrón origen de la excitación.
1.3 MASA Y ENERGÍA. UNIDADES
Unidad de masa atómica
Los protones y neutrones tienen masas del orden de 10 -27kg (ver Tabla I ), excesivamente pequeñas para utilizar el kilogramo como unidad de medida. Por ello en física atómica y nuclear se recurre para la medida de las masas implicadas a la "unidad de masa atómica" , definida como la doceava parte de la masa de un átomo neutro de 12C. La abreviatura establecida para la unidad de masa atómica, también denominada "unidad de masa unificada", es 'u'. Pero en el texto se mantendrá, por facilidad de referencia, su notación anterior 'uma'. Por tanto:

La unidad de masa atómica resulta, en efecto, una unidad más apropiada para el contexto atómico, puesto que corresponde aproximadamente a la masa de un nucleón:
mp = 1,007276 uma
mn = 1,008665 uma
Respecto a la masa del electrón en reposo, vale:
me = 0,000549 uma
De este modo, y como recoge la Tabla I comparativa de las propiedades de electrón, protón y neutrón, estos dos últimos poseen una masa unas 2000 veces mayor que la del electrón (1836 y 1839 veces mayor, respectivamente), tal como se había anticipado.
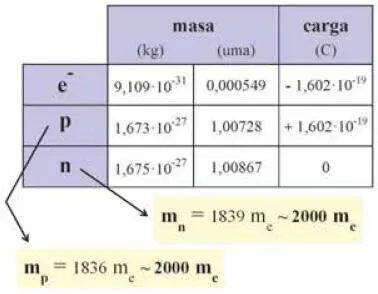
Tabla I Masa y carga eléctrica (en coulomb) de los constituyentes atómicos.
Читать дальше















