p = p A 0 x A+ p B 0 x B= p A 0(1 – x B) + p B 0 x B = p A 0 – x B(p A 0– p B 0)
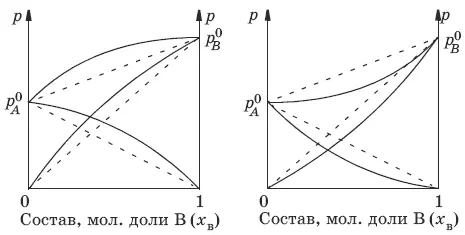
Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения, ΔН тв> 0). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения, ΔH раств< 0).
Температура кристаллизации разбавленных растворов
Второй закон Рауля. Понижение температуры замерзания раствора ΔТ зампрямо пропорционально моляльной концентрации раствора: ΔT зам = Т 0– Т = КС m, где Т 0– температура замерзания чистого растворителя; Т – температура замерзания раствора; К – криоскопическая постоянная растворителя, град/кг моль,
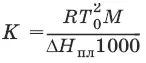
Т 0 2 – температура замерзания растворителя; М – молекулярная масса растворителя, ΔН пл– мольная теплота плавления растворителя.
Температура кипения разбавленных растворов
Температура кипения – температура, при которой давление насыщенного пара становится равным внешнему давлению.
Повышение температуры кипения растворов нелетучих веществ Δ Т К= Т к– Т к 0 пропорционально понижению давления насыщенного пара и прямо пропорционально моляльной концентрации раствора: ΔТ кип= ЕС m, где Е – эбулиоскопическая постоянная растворителя, град/кг • моль,
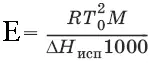
Осмотическое давление разбавленных растворов
Осмос – преимущественно одностороннее прохождение молекул растворителя через полупроницаемую мембрану в раствор или молекул растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией.
Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, численно равно осмотическому давлению π (Па).
Принцип Вант-Гоффа: осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор: π = CRT.
Изотонические растворы – два раствора с одинаковым осмотическим давлением (π 1= π 2).
Гипертонический раствор – раствор, осмотическое давление которого больше, чем у другого (π 1 > π 2).
Гипотонический раствор – раствор, осмотическое давление которого меньше, чем у другого (π 1 < π 2).
3.3. Растворы электролитов
Степень диссоциации α – отношение числа молекул n, распавшихся на ионы, к общему числу молекул N:
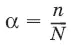
Изотонический коэффициент i Ван-Гоффа – отношение фактического числа частиц в растворе электролита к числу частиц этого раствора без учета диссоциации.
Если из N молекул продиссоциировало n, причем каждая молекула распалась на ν ионов, то
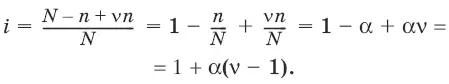
Для неэлектролитов i = 1.
Для электролитов 1 < i ≤ ν.
3.4. Коллигативные свойства растворов электролитов:
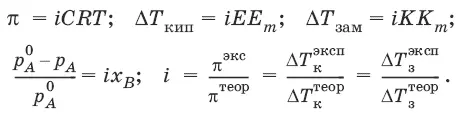
Теория электролитической диссоциации Аррениуса
1. Электролиты в растворах распадаются на ионы – диссоциируют.
2. Диссоциация является обратимым равновесным процессом.
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т. е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность.
По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0,7), средней силы (0,3 < α < 0,7) и слабые (α ≤ 0,3).
Читать дальше
Конец ознакомительного отрывка
Купить книгу


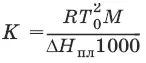
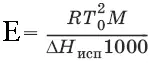
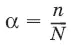
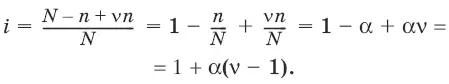
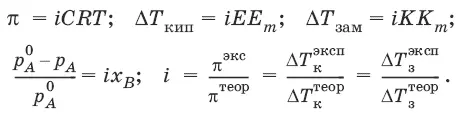







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



