Ионы Н +и OH¯ обладают аномально высокой подвижностью, что связано с особым механизмом переноса заряда этими ионами – эстафетным механизмом. Между ионами гидроксония Н 3O +и молекулами воды, а также между молекулами воды и ионами OH¯ непрерывно происходит обмен протонами по уравнениям:
Н 3O ++ Н 2O → Н 2O + Н 3O +
Н 2O + OH¯ → OH¯ + Н 2O
5. Электрохимические процессы
5.1. Электродные потенциалы. Гальванические элементы. ЭДС
При соприкосновении двух химически или физически разнородных материалов (металл 1 (проводник I рода) – металл 2 (проводник I рода), металл (проводник I рода) – раствор соли металла (проводник II рода), раствор электролита 1 (проводник II рода) – раствор электролита 2 (проводник II рода) и т. д.) между ними возникает двойной электрический слой (ДЭС). ДЭС является результатом упорядоченного распределения противоположно заряженных частиц на границе раздела фаз.
Образование ДЭС приводит к скачку потенциала φ, который в условиях равновесия металл (проводник I рода) – раствор соли металла (проводник II рода) называется галъвани-потенциалом.
Система: металл (Me) – водный раствор соли данного Me – называется электродом или полуэлементом и схематически изображается следующим образом:
Ме n+| Me
Электрод (п/э) записывается так, чтобы все вещества, находящиеся в растворе, были помещены слева, а электродный материал – справа от вертикальной черты.
φ > 0, если на электроде протекает реакция восстановления Ме n++ nе¯ ↔ Ме 0,
φ < 0, если на электроде протекает реакция окисления Ме 0 ↔ Ме n++ nе¯.
Электродным потенциалом Е Ме n+/Меназывается равновесная разность потенциалов, возникающая на границе фаз проводник I рода/проводник II рода и измеренная относительно стандартного водородного электрода.
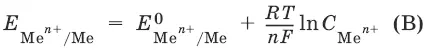
уравнение Нернста, где n – число электронов, участвующих в электродной реакции; С Ме n+– концентрация катионов; Е Ме n+/Ме – стандартный электродный потенциал.
Контактный потенциал φ χ – равновесный скачек потенциалов, возникающий на границе раздела двух проводников I рода.
Диффузионный потенциал φ диф– равновесная разность потенциалов, возникающая на границе фаз проводник II рода/проводник II рода.
Гальванический элемент (г. э.) – электрическая цепь, состоящая из двух или нескольких п.э. и производящая электрическую энергию за счет протекающей в ней химической реакции, причем стадии окисления и восстановления химической реакции пространственно разделены.
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления, – катодом.
Правила ИЮПАК для записи гальванических элементов и реакций, протекающих в них
1. В г. э. работа производится, поэтому ЭДС элемента считается величиной положительной.
2. Величина ЭДС гальванической цепи Е определяется алгебраической суммой скачков потенциала на границах раздела всех фаз, но так как на аноде протекает окисление, то ЭДС рассчитывают, вычитая из числового значения потенциала катода (правого электрода) значение потенциала анода (левого электрода) – правило правого полюса. Поэтому схему элемента записывают так, чтобы левый электрод был отрицательным (протекает окисление), а правый – положительным (протекает процесс восстановления).
3. Границу раздела между проводником I рода и проводником II рода обозначают одной чертой.
4. Границу между двумя проводниками II рода изображают пунктирной чертой.
5. Электролитный мостик на границе двух проводников II рода обозначают двумя пунктирными чертами.
6. Компоненты одной фазы записывают через запятую.
7. Уравнение электродной реакции записывают так, чтобы слева располагались вещества в окисленной форме (Ох), а справа – в восстановленной (Red).
Гальванический элемент Даниэля-Якоби состоит из цинковой и медной пластин, погруженных в соответствующие растворы ZnSO 4и CuSO 4, которые разделены солевым мостиком с раствором KCl: электролитический мостик обеспечивает электрическую проводимость между растворами, но препятствует их взаимной диффузии.
(-) Zn | Zn 2+:: Cu 2+| Cu (+)
Реакции на электродах:
Zn 0 → Zn 2++ 2e¯
Cu 2++ 2е¯ → Cu 0
Суммарный окислительно-восстановительный процесс:
Читать дальше
Конец ознакомительного отрывка
Купить книгу








![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



