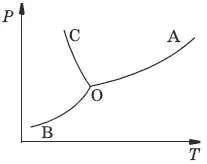
Внутри каждой из областей диаграммы (АОВ, ВOC, АOC) система однофазна; С = 2 (система бивариантна).
На каждой из линий число фаз в системе равно двум, и, согласно правилу фаз, система моновариантна: С = 1 – 2 + 2 = 1, т. е. для каждого значения температуры имеется только одно значение давления.
Влияние давления на температуру фазового перехода описывает уравнение Кла-узиуса – Клапейрона:
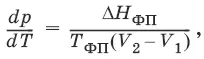
V 2, V 1 – изменение молярного объема вещества при фазовом переходе.
Кривая равновесия «твердое вещество – жидкость» на диаграмме состояния воды наклонена влево, а на диаграммах состояния остальных веществ – вправо, т. к. плотность воды больше, чем плотность льда, т. е. плавление сопровождается уменьшением объема (AV < 0). В этом случае увеличение давления будет понижать температуру фазового перехода «твердое тело – жидкость» (вода – аномальное вещество). Для всех остальных веществ (т. н. нормальные вещества) ΔV пл > 0 и, согласно уравнению Клаузиуса-Клапейрона, увеличение давления приводит к повышению температуры плавления.
3.1. Термодинамика растворов
Раствор– гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения ее свойств.
Диффузия в растворах
Диффузия – самопроизвольный процесс выравнивания концентрации вещества в растворе за счет теплового движения его молекул или атомов.
Закон Фика: количество вещества, диффундирующее за единицу времени через единицу площади поверхности пропорционально градиенту его концентрации:
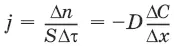
где j – диффузионный поток; D – коэффициент диффузии.
Уравнение Эйнштейна-Смолуховского:
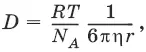
где η – вязкость среды; R – радиус диффундирующих частиц.
Растворимость газов в газах
Закон Дальтона: общее давление газовой смеси равно сумме парциальных давлений всех входящих в нее газов:
Р общ= Σ p i и pi = xi Р общ
Закон Генри-Дальтона: растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью: C i= kp i, где C i – концентрация раствора газа в жидкости; k – коэффициент пропорциональности, зависящий от природы газа.
Как правило, при растворении газа в жидкости выделяется теплота (к < 0), поэтому с повышением температуры растворимость уменьшается.
Формула Сеченова:
X =Х 0е -kС эл
где X и Х 0 – растворимость газа в чистом растворителе и растворе электролита с концентрацией С.
3.2. Коллигативные свойства растворов неэлектролитов
Коллигативными (коллективными) называются свойства растворов относительно свойств растворителя, зависящие главным образом от числа растворенных частиц.
Давление насыщенного пара разбавленных растворов
Пар, находящийся в равновесии с жидкостью, называется насыщенным. Давление такого пара р 0 называется давлением или упругостью насыщенного пара чистого растворителя.
Первый закон Рауля. Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом:
p i= p i 0x i
Для бинарного раствора, состоящего из компонентов А и В: относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества:
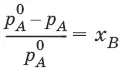
Растворы, для которых выполняется закон Рауля, называют идеальными растворами.
Давление пара идеальных и реальных растворов
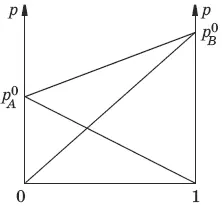
Если компоненты бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента. Общее Состав, мол. доли в (х в) давление пара:
Читать дальше
Конец ознакомительного отрывка
Купить книгу


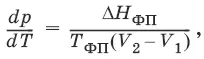
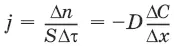
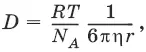
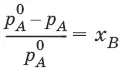








![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



