Слабые электролиты. Константа диссоциации
Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
А аВ b ↔ аА x-+ bВ y+
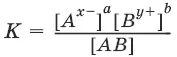
Для бинарного электролита:
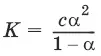
Для разбавленных растворов можно считать, что (1 – α) = 1 и К ≈ α 2С.
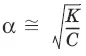
– закон разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора.
Активность растворенного вещества – эмпирическая величина, заменяющая концентрацию, – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f , который является мерой отклонения свойств реального раствора от идеального:
а = fC; а += f +С +; а_ = f_C_.
Для бинарного электролита:
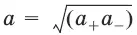
– средняя активность электролита;
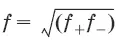
– средний коэффициент активности.
Предельный закон Дебая-Хюккеля для бинарного электролита: lg f = -0,51z 2I ½, где z – заряд иона, для которого рассчитывается коэффициент активности;
I – ионная сила раствора I = 0,5Σ(С ir i 2).
4. Электропроводность растворов электролитов
Проводники I рода – металлы и их расплавы, в которых электричество переносится электронами.
Проводники II рода – растворы и расплавы электролитов с ионным типом проводимости.
Электрический ток есть упорядоченное перемещение заряженных частиц.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см 2:
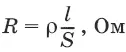
Величина W, обратная сопротивлению, называется электропроводностью – количественной меры способности раствора электролита проводить электрический ток.
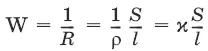
Удельная электропроводность χ(к) – электропроводность проводника I рода длиной 1 м с площадью поперечного сечения 1 м 2или электропроводность 1 м 3(1 см 3) раствора электролита (проводника II рода) при расстоянии между электродами 1 м (1 см) и площади электродов 1 м 2(1 см 2).
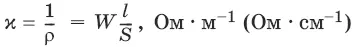
Молярная электропроводность раствора) λ – электропроводность раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга.
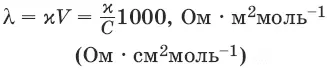
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т. е. с увеличением разведения раствора V = 1/ C), достигая некоторого предельного значения λ 0 (λ ∞), называемого молярной электропроводностью при бесконечном разведении.
Для бинарного электролита с однозарядными ионами при постоянной температуре и напряженности поля 1 В • м -1:
λ = α F(u ++ и¯),
где F – число Фарадея; и +, и¯ – абсолютные подвижности (м 2В -1с -1) катиона и аниона – скорости движения данных ионов в стандартных условиях, при разности потенциалов в 1В на 1 м длины раствора.
λ += Fu +; λ¯ = Fu¯,
где λ +, λ¯ – подвижности катиона и аниона, Ом • м 2• моль -1(Ом • см 2• моль -1).
λ = α(λ ++ λ¯)
Для сильных электролитов α ≈1 и λ = λ ++ λ¯
При бесконечном разбавлении раствора (V → ∞, λ + → λ ∞ +, λ¯ → λ ∞ ¯, α → 1) как для сильного, так и для слабого электролитов λ ∞= λ ∞ + – λ ∞ ¯ – закон Кольрауша: молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей λ ∞ + , λ ∞ ¯ катиона и аниона данного электролита.
Читать дальше
Конец ознакомительного отрывка
Купить книгу

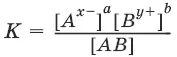
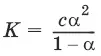
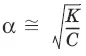
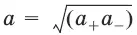
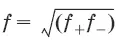
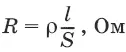
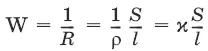
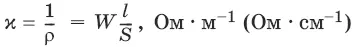
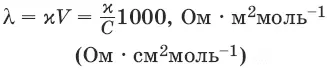







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



