Cu 2++ Zn 0 → Cu 0+ Zn 2+
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала.
Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента Е.
ЭДС элемента E Zn/ Cu= φ Cu 2+/Cu+ φ Zn 2+/Zn + φ к+ φ диф.
Без учета φ дифи φ к: E Zn / Cu = φ Cu 2+/Cu+ φ Zn 2+/Zn = Е Cu 2+/Cu + Е Zn 2+/Zn– гальванические элементы, состоящие из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями С 1> С 2. Катодом в этом случае будет являться электрод с большей концентрацией, т. к. стандартные электродные потенциалы обоих электродов равны.
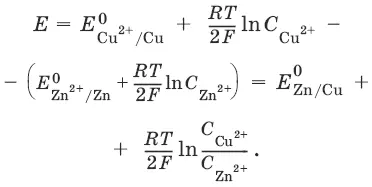
Концентрационные цепи
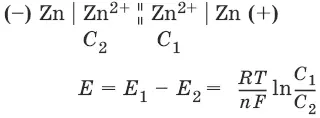
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный.
Работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
5.2. Классификация электродов
Электроды первого рода. Металлическая пластинка, погруженная в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл.
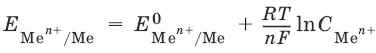
Электроды второго рода. Металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона.
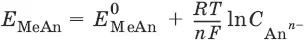
Электроды сравнения – электроды с точно известными и воспроизводимыми значениями потенциалов.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом.
Pt, Н 2/ Н +
Электрохимическое равновесие на электроде:
2Н ++ 2е¯ ↔ Н 2.
Потенциал стандартного водородного электрода (с активностью ионов Н +1 моль/л и давлением водорода 101,3 кПа) принят равным нулю.
Электродный потенциал нестандартного водородного электрода:
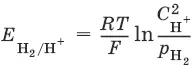
Каломельный электрод состоит из ртутного электрода, помещенного в раствор KCl, определенной концентрации и насыщенный каломелью Hg 2Cl 2:
Hg / Hg 2Cl 2, KCl
Каломельный электрод обратим относительно анионов хлора
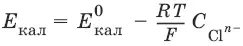
Хлорсеребряный электрод – обратим относительно анионов хлора:
Ag / AgCl, KCl
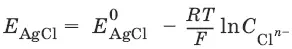
Если раствор KCl – насыщенный, то E AgC l= 0,2224 – 0,00065(t – 25), В.
Индикаторные электроды.Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе.
Хингидронный электрод представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С 6Н 4O 2• С 6Н 4(OH) 2– соединения хинона С 6Н 4O 2и гидрохинона С 6Н 4(OH) 2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
С 6Н 4O 2+ 2H ++ 2е¯ → С 6Н 4(OH) 2
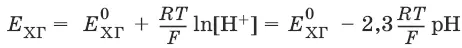
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется буферным раствором с определенным значением рН, в который погружен вспомогательный электрод (обычно хлорсеребряный). Для измерения рН стеклянный электрод погружают в исследуемый раствор в паре с электродом сравнения. Шарик стеклянного электрода предварительно обрабатывают в течение длительного времени раствором кислоты. При этом ионы водорода внедряются в стенки шарика, замещая катионы щелочного металла. Электродный процесс сводится к обмену ионами водорода между двумя фазами – исследуемым раствором и стеклом: Н р-р ↔ Н ст +.
Читать дальше
Конец ознакомительного отрывка
Купить книгу

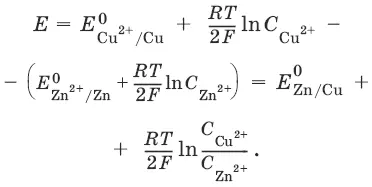
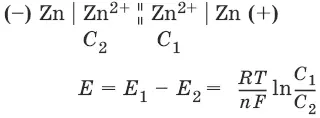
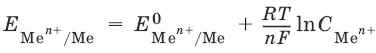
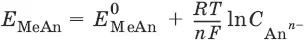
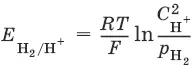
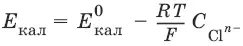
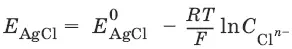
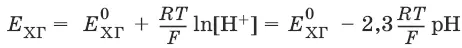







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



