6.2. Адсорбция на границе твердое тело – газ
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий адсорбированной молекулы с поверхностью, характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т. е. экзотермичностью (тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата 10–80 кДж/моль).
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата, обычно необратима; является локализованной, т. е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40-120 кДж/моль, повышение температуры способствует ее протеканию.
Уравнение Генри (мономолекулярная адсорбция на однородной поверхности при низких давлениях или малых концентрациях):
Г = Кс или Г = Кр,
К – константа адсорбционного равновесия, зависящая от природы адсорбента и адсорбата; С, р – концентрация растворенного вещества или давление газа.
Теория мономолекулярной адсорбции Лэнгмюра
1. Адсорбция является локализованной и вызывается силами, близкими к химическим.
2. Адсорбция происходит на однородной поверхности адсорбента.
3. На поверхности может образоваться только один слой адсорбированных молекул.
4. Процесс адсорбции является обратимым и равновесным.
Изотерма адсорбции Лэнгмюра:
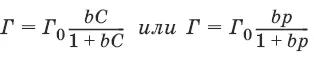
где Г 0– емкость монослоя – константа, равная предельной адсорбции, наблюдаемой при относительно больших равновесных концентрациях, моль/м 2; b – константа, равная отношению константы скорости адсорбции и константе скорости десорбции.
Уравнение Фрейндлиха (адсорбция на неоднородной поверхности): Г = К Фс n, где. К Ф – константа, численно равная адсорбции при равновесной концентрации, равной единице; n – константа, определяющая кривизну изотермы адсорбции (n = 0,1–0,6).
Молекулярная адсорбция из растворов:
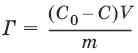
где С 0– исходная концентрация адсорба-та; С – равновесная концентрация адсорбата; V – объем раствора адсорбата; m – масса адсорбента.
Площадь S 0, приходящаяся на одну молекулу в насыщенном адсорбционном слое, – посадочная площадка:
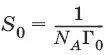
м 2/молекула.
Толщина адсорбционного слоя:
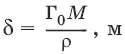
где М – молекулярная масса ПАВ; ρ – плотность ПАВ.
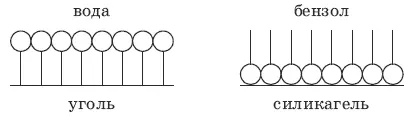
Правило Ребиндера: на полярных адсорбентах лучше адсорбируются полярные ад-сорбаты из малополярных растворителей; на полярных адсорбентах – неполярные адсорбаты из полярных растворителей.
Ориентация молекул ПАВ на поверхности адсорбента схематически изображена на рисунке:
6.3. Адсорбция из растворов электролитов
Обменная адсорбция – процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого-либо знака (катионы либо анионы) и вместо них может выделять в раствор эквивалентное число других ионов того же знака. Ввсегда специфична, т. е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима.
Правило Пакета-Пескова-Фаянса: на поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящих в состав кристалла, малорастворимое соединение.
7. Коллоидные (дисперсные) системы
Коллоидной (дисперсной) системой называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы. Это ультрамикрогетерогенные системы, состоящие из частиц дисперсной фазы – совокупности раздробленных частиц, размер которых лежит в пределах 10 -9-10 -5 м, и непрерывной дисперсионной среды, в которой распределены эти частицы.
Читать дальше
Конец ознакомительного отрывка
Купить книгу

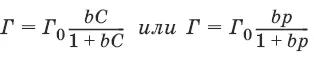
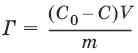
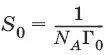
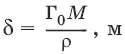








![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



