Ричард Фейнман - 4. Кинетика. Теплота. Звук
Здесь есть возможность читать онлайн «Ричард Фейнман - 4. Кинетика. Теплота. Звук» весь текст электронной книги совершенно бесплатно (целиком полную версию без сокращений). В некоторых случаях можно слушать аудио, скачать через торрент в формате fb2 и присутствует краткое содержание. Жанр: Физика, на русском языке. Описание произведения, (предисловие) а так же отзывы посетителей доступны на портале библиотеки ЛибКат.
- Название:4. Кинетика. Теплота. Звук
- Автор:
- Жанр:
- Год:неизвестен
- ISBN:нет данных
- Рейтинг книги:4 / 5. Голосов: 1
-
Избранное:Добавить в избранное
- Отзывы:
-
Ваша оценка:
- 80
- 1
- 2
- 3
- 4
- 5
4. Кинетика. Теплота. Звук: краткое содержание, описание и аннотация
Предлагаем к чтению аннотацию, описание, краткое содержание или предисловие (зависит от того, что написал сам автор книги «4. Кинетика. Теплота. Звук»). Если вы не нашли необходимую информацию о книге — напишите в комментариях, мы постараемся отыскать её.
4. Кинетика. Теплота. Звук — читать онлайн бесплатно полную книгу (весь текст) целиком
Ниже представлен текст книги, разбитый по страницам. Система сохранения места последней прочитанной страницы, позволяет с удобством читать онлайн бесплатно книгу «4. Кинетика. Теплота. Звук», без необходимости каждый раз заново искать на чём Вы остановились. Поставьте закладку, и сможете в любой момент перейти на страницу, на которой закончили чтение.
Интервал:
Закладка:

Это уравнение говорит нам, что при путешествии заряда DZ по батарее меняется внутренняя энергия U. Но почему DU/DZ — это не просто э. д. с. батареи E? Дело в том, что в реальных обстоятельствах движение зарядов внутри батареи вызывает выделение тепла. Внутренняя анергия батареи изменяется, во-первых, за счет работы, производимой батареей во внешней цепи, и, во-вторых, за счет нагревания батареи. Интересно, что вторую часть изменения внутренней энергии опять-таки можно подсчитать, следя, как меняется э. д. с. батареи при изменении температуры. Между прочим, когда заряды текут по батарее, там происходят химические реакции, и уравнение (45.9) указывает на отличный способ измерения необходимой для реакции энергии. Для этого нам нужно лишь сделать батарею, работающую на этой реакции, и сначала просто измерить э. д. с., а потом проследить, как меняется э. д. с. с температурой, если ни один заряд не выпускается из батареи!
Мы предположили, что объем батареи можно поддерживать постоянным, только поэтому мы позволили себе пренебречь членом PDV и считать, что работа батареи равна EDZ. Но оказывается, что поддерживать объем постоянным технически очень трудно. Гораздо легче держать батарею под постоянным атмосферным давлением. Вот почему химики не любят только что написанных нами уравнений: они предпочитают уравнения, которые были бы связаны с постоянным давлением. Мы с самого начала этой главы за независимые переменные приняли V и Т. Химикам больше нравятся Р и Т, поэтому посмотрим теперь, как преобразуются наши выводы при переходе к химической системе переменных. Постарайтесь при этом не ошибиться, потому что мы как-никак сменили детали и перешли от Т и V к Т и Р.
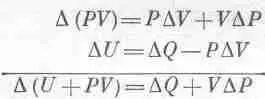
Начнем с (45.3), где DU=DQ-PDV; член PDV можно заменить на E D Z или даже на А D В. Если бы нам удалось как-нибудь заменить PDV на VDP, тогда V и Р поменялись бы ролями и химики остались бы довольны. Тот, кто сообразителен, заметит, что дифференциал произведения PV равен d(PV)=PdV+VdP. Добавив это равенство к (45.3), он получит
Чтобы все наши последующие выводы походили на выводы из уравнения (45.3), давайте будем считать U+PV какой-то новой функцией, назовем ее энтальпией Н, и напишем в таком виде: DH=DQ+VDP.
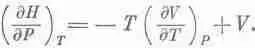
Вот теперь мы готовы перевести все наши рассуждения на химический язык, надо только помнить, что U®H, Р ® V, V®P. Химики считают, что вся термодинамика содержится не в уравнении (45.7), а в уравнении
Выяснив, как происходит переход к химическим переменным Т и Р, вернемся к нашим старым переменным. Теперь и уже до конца главы нашими независимыми переменными будут Т и V. Сейчас давайте применим полученные результаты к некоторым физическим процессам. Сначала рассмотрим идеальный газ. Из кинетической теории известно, что внутренняя энергия газа зависит только от характера движения молекул и от их числа. Внутренняя энергия зависит только от Т, а к V она безразлична. Если изменять V при постоянной Т, то U не изменится. Значит, (dU/dV) T =0, и уравнение (45.7) говорит нам, что для идеального газа
Т(дP/дT) V -Р =0 . (45.10)
Уравнение (45.10) — это дифференциальное уравнение, и оно кое-что расскажет нам о Р. Мы расправимся с частной производной так: поскольку частная производная вычислена при постоянном V, можно заменить частную производную обычной, только надо помнить, что все это делается «при постоянном V». Уравнение (45.10) тогда принимает вид
Т=DP/DT-P =0 (при постоянном V), (45.11)
интегрирование не составит для нас труда, и мы получим ln P= ln Т +const (при постоянном V),
P=constXT (при постоянном V). (45.12)
Мы знаем, что давление идеального газа равно
Р=RT/V. (45.13)
Это соотношение совместимо с (45.12), потому что R и V — постоянные. Но зачем же мы мучились, решая эти уравнения? Ведь результат-то был уже известен. Потому что мы пользовались двумя независимыми определениями температуры! Однажды мы предположили, что кинетическая энергия молекул пропорциональна температуре. Это предположение привело нас к температурной шкале, которую мы назвали шкалой идеального газа. Температура Т в уравнении (45.13) отсчитывается по газовой шкале. Мы называли отсчитанную по газовой шкале температуру кинетической температурой. Потом мы определили температуру иначе, и это определение вообще не нуждалось ни в каком веществе. Исходя из второго закона, мы определили то, что можно назвать «абсолютной термодинамической температурой» Т; она появляется в уравнении (45.12). Здесь мы только доказали, что давление идеального газа (идеальный газ для нас нечто, чья внутренняя энергия не зависит от объема) пропорционально абсолютной термодинамической температуре. Мы, кроме того, знаем, что давление пропорционально температуре, измеренной по газовой шкале. Таким образом, можно заключить, что кинетическая температура пропорциональна «абсолютной термодинамической температуре». Это, конечно, означает, что если бы мы были благоразумны, то показания обеих шкал могли бы всегда жить в согласии. В конце концов эти шкалы можно выбрать так, что они совпадут; постоянную пропорциональности можно положить равной единице. Очень долго люди сами себе создавали трудности, но наконец превратили две шкалы в одну!
Читать дальшеИнтервал:
Закладка:
Похожие книги на «4. Кинетика. Теплота. Звук»
Представляем Вашему вниманию похожие книги на «4. Кинетика. Теплота. Звук» списком для выбора. Мы отобрали схожую по названию и смыслу литературу в надежде предоставить читателям больше вариантов отыскать новые, интересные, ещё непрочитанные произведения.
Обсуждение, отзывы о книге «4. Кинетика. Теплота. Звук» и просто собственные мнения читателей. Оставьте ваши комментарии, напишите, что Вы думаете о произведении, его смысле или главных героях. Укажите что конкретно понравилось, а что нет, и почему Вы так считаете.




![Ричард Фейнман - Фейнмановские лекции по физике. Современная наука о природе [litres]](/books/398001/richard-fejnman-fejnmanovskie-lekcii-po-fizike-sov-thumb.webp)

