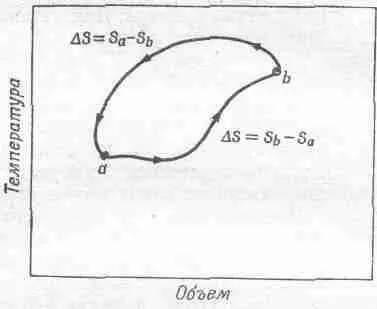
Фиг. 44.11. Изменение энтропии за полный обратимый цикл. Полное изменение энтропии равно нулю.
Вспомним еще, что по мере продвижения вдоль этого пути энтропия (тепло, выделяемое при единичной температуре) возрастает в согласии с правилом dS=dQ/T, где dQ — тепло, изъятое из вещества при температуре Т.
Мы уже знаем, что после обратимого цикла полная энтропия всего, что включается в процесс, не изменяется. Ведь тепло Q 1, поглощенное при T 1, и тепло Q 2 , выделенное при Т 2 , вносят в энтропию равные по величине, но противоположные по знаку вклады. Поэтому чистое изменение энтропии равно нулю. Таким образом, при обратимом цикле энтропия всех участников цикла, включая резервуары, не изменяется. Это правило как будто похоже на закон сохранения энергии, но это не так. Оно применимо только к обратимым циклам. Если перейти к необратимым циклам, то закона сохранения энтропии уже не существует.
Приведем два примера. Для начала предположим, что какая-то машина с трением производит необратимую работу, выделяя тепло Q при температуре Т. Энтропия возрастет на Q/Т. Тепло Q равно затраченной работе, и когда мы производим какую-то работу с помощью трения о какой-то предмет, температура которого равна Т, то энтропия возрастает на величину W/Т.
Другой пример необратимости: если приложить друг к другу два предмета с разными температурами, скажем Т 1 и Т 2 , то от одного предмета к другому перетечет некоторое количество тепла. Предположим, например, что мы бросили в холодную воду горячий камень. Насколько изменяется энтропия камня, если он отдает воде тепло D Q при температуре T 1 ?Она уменьшается на A DQ/T 1. А как изменяется энтропия воды? Она возрастет на D Q/T 2 . Тепло, конечно, может перетечь только от более высокой температуры Т 1 к более низкой Т 2 . Поэтому если T 1больше Т 2 , то DQ положительно. Таким образом, изменение энтропии положительно и равно разности двух дробей:
DS=DQ/T 2-DQ/T 1 . (44.19)
Итак, справедлива следующая теорема: в любом необратимом процессе энтропия всего на свете возрастает. Только обратимые процессы могут удержать энтропию на одном уровне. А поскольку абсолютно необратимых процессов не существует, то энтропия всегда понемногу растет. Обратимые процессы — это идеализированные процессы с минимальным приростом энтропии.
К сожалению, нам не придется углубиться в область термодинамики. Наша цель лишь проиллюстрировать основные идеи этой науки и объяснить причины, по которым возможно основываться на этих аргументах. Но в нашем курсе мы не будем часто прибегать к термодинамике. Термодинамикой широко пользуются в технике и в химии. Поэтому с термодинамикой вы практически познакомитесь в курсе химии или технических наук. Ну а дублировать нет смысла, и мы ограничимся лишь некоторым обзором природы теории и не будем вдаваться в детали для специальных ее применений.
Два закона термодинамики часто формулируют так:
Первый закон: Энергия Вселенной всегда постоянна. Второй закон: Энтропия Вселенной всегда возрастает.
Это не слишком хорошая формулировка второго закона. В ней ничего не говорится, например, о том, что энтропия не изменяется после обратимого цикла и не уточняется само понятие энтропии. Просто это легко запоминаемая форма обоих законов, но из нее нелегко понять, о чем собственно идет речь.
Все законы, о которых сейчас шла речь, мы собрали в табл. 44.1. А в следующей главе мы используем эту сводку законов, чтобы найти соотношение между теплом, выделяемым резиной при растяжении, и дополнительным натяжением резины при ее нагревании.
Таблица 44. 1 · ЗАКОНЫ ТЕРМОДИНАМИКИ

* Раньше мы определяли температурную шкалу иначе. Мы утверждали, что средняя кинетическая энергия молекулы идеального газа пропорциональна температуре или, согласно закону идеального газа, что pV пропорционально Т. Эквивалентно ли это новому определению? Да. Ведь окончательный результат (44.7), выведенный из закона идеального газа, совпадает с приведенным здесь результатом. Мы еще поговорим об этом в следующей главе.
Читать дальше






![Ричард Фейнман - Фейнмановские лекции по физике. Современная наука о природе [litres]](/books/398001/richard-fejnman-fejnmanovskie-lekcii-po-fizike-sov-thumb.webp)

