Глава 45
ПРИМЕРЫ ИЗ ТЕРМОДИНАМИКИ
§ 1. Внутренняя энергия
§ 2. Применения
§ 3. Уравнение Клаузиуса –Клайперона
§ 1. Внутренняя энергия
Когда приходится использовать термодинамику для дела, то оказывается, что она очень трудный и сложный предмет. В этой книге, однако, мы не будем залезать в самые дебри. Эта область особенно интересна для химиков и инженеров, и тем, кому захочется получше познакомиться с ней, следует обратиться к физической химии или инженерной термодинамике. Есть еще ряд хороших справочных книг, в которых эта тема обсуждается более подробно.
Термодинамика сложна потому, что каждое явление она позволяет описывать многими способами. Если нам нужно описать поведение газа, то мы можем исходить из того, что его давление зависит от температуры и объема, а можно предположить, что объем зависит от давления и температуры. То же самое и с внутренней энергией U: можно сказать, что она определяется температурой и объемом, стоит только выбрать именно эти переменные, но можно говорить о зависимости от температуры и давления или от давления и объема и т. д. В предыдущей главе мы познакомились с другой функцией температуры и объема, называемой энтропией S. И теперь ничто не помешает нам построить другие функции этих переменных. Например, функция U-TS тоже зависит от температуры и объема. Таким образом, нам приходится иметь дело с большим количеством разных величин, зависящих от разнообразных комбинаций переменных.
Чтобы упростить понимание этой главы, договоримся с самого начала выбрать в качестве независимых переменных температуру и объем. Химики используют для этого температуру и давление, потому что их легче измерять и контролировать в химических реакциях. Но мы используем повсюду в этой главе температуру и объем и изменим этому только в одном месте, чтобы посмотреть, как совершается переход к химическим переменным.
Итак, сначала рассмотрим только одну систему независимых переменных — температуру и объем. Затем нас будут интересовать только две функции этих переменных: внутренняя энергия и давление. Все другие термодинамические функции можно получить с помощью этих двух, но не обязательно это делать именно сейчас. Даже после таких ограничений термодинамика останется еще трудным предметом, но все же уже не столь невозможным для понимания!
Сначала немного займемся математикой. Если величина есть функция от двух переменных, то дифференцировать ее придется осторожнее, чем мы это делали раньше, имея дело с одной переменной. Что мы понимаем под производной давления по температуре? Изменение давления, сопровождающее изменение температуры, разумеется, зависит от того, что случилось с объемом, пока менялась температура. Прежде чем понятие производной по температуре обретет ясный смысл, надо сказать что-то определенное об изменении объема. Например, можно спросить, какова скорость изменения Р относительно Т при постоянном объеме. Тогда отношение изменений обеих этих величин, по существу, обычная производная, которой привыкли присваивать символ dP/dT. Мы обычно используем особый символ дР/дТ, он напоминает нам, что Р зависит, кроме Т, еще и от переменной V, и эта переменная не изменяется. Чтобы подчеркнуть тот факт, что V не изменяется, мы не только используем символ д, но еще пометим индексом остающуюся постоянной переменную (дР/дТ) у . Конечно, поскольку имеются только две независимые переменные, то это обозначение излишне, но оно, быть может, поможет нам легче пройти сквозь термодинамические дебри частных производных.
Предположим, что функция f(x, у) зависит от двух независимых переменных х и у. Под символом (дf/дх) у мы понимаем самую обычную производную, получаемую общепринятым способом, если у постоянна:
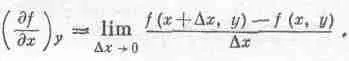
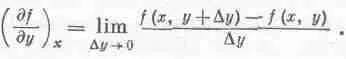
Аналогично определяется и
Например, если f(x, у)=х 2 +ух, то (df/dx) y =2x+y, а (дfду) х =х. Мы можем распространить это на старшие производные:
д 2 f/дy 2 или д 2 f/дудх.
Последний случай означает, что сначала f продифференцировано по х, считая у постоянным, а затем результат продифференцирован по у, но теперь постоянным стало х. Порядок дифференцирования не имеет значения:
Читать дальше

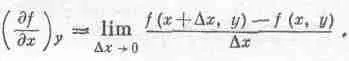
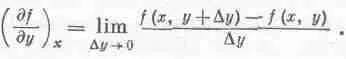



![Ричард Фейнман - Фейнмановские лекции по физике. Современная наука о природе [litres]](/books/398001/richard-fejnman-fejnmanovskie-lekcii-po-fizike-sov-thumb.webp)

