Приведем два примера. Для начала предположим, что какая-то машина с трением производит необратимую работу, выделяя тепло Q при температуре Т. Энтропия возрастет на Q / Т . Тепло Q равно затраченной работе, и когда мы производим какую-то работу с помощью трения о какой-то предмет, температура которого равна Т , то энтропия возрастает на величину W / Т .
Другой пример необратимости: если приложить друг к другу два предмета с разными температурами, скажем Т 1и Т 2, то от одного предмета к другому перетечет некоторое количество тепла. Предположим, например, что мы бросили в холодную воду горячий камень. Насколько изменяется энтропия камня, если он отдает воде тепло Δ Q при температуре T1?Она уменьшается на ΔQ/T 1. А как изменяется энтропия воды? Она возрастет на Δ Q / T 2. Тепло, конечно, может перетечь только от более высокой температуры Т 1к более низкой Т 2. Поэтому если T 1больше Т 2, то ΔQ положительно. Таким образом, изменение энтропии положительно и равно разности двух дробей:
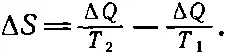 (44.19)
(44.19)
Итак, справедлива следующая теорема: в любом необратимом процессе энтропия всего на свете возрастает. Только обратимые процессы могут удержать энтропию на одном уровне. А поскольку абсолютно необратимых процессов не существует, то энтропия всегда понемногу растет. Обратимые процессы — это идеализированные процессы с минимальным приростом энтропии.
К сожалению, нам не придется углубиться в область термодинамики. Наша цель лишь проиллюстрировать основные идеи этой науки и объяснить причины, по которым возможно основываться на этих аргументах. Но в нашем курсе мы не будем часто прибегать к термодинамике. Термодинамикой широко пользуются в технике и в химии. Поэтому с термодинамикой вы практически познакомитесь в курсе химии или технических наук. Ну а дублировать нет смысла, и мы ограничимся лишь некоторым обзором природы теории и не будем вдаваться в детали для специальных ее применений.
Два закона термодинамики часто формулируют так:
Первый закон : Энергия Вселенной всегда постоянна.
Второй закон : Энтропия Вселенной всегда возрастает.
Это не слишком хорошая формулировка второго закона. В ней ничего не говорится, например, о том, что энтропия не изменяется после обратимого цикла и не уточняется само понятие энтропии. Просто это легко запоминаемая форма обоих законов, но из нее нелегко понять, о чем собственно идет речь.
Все законы, о которых сейчас шла речь, мы собрали в табл. 44.1. А в следующей главе мы используем эту сводку законов, чтобы найти соотношение между теплом, выделяемым резиной при растяжении, и дополнительным натяжением резины при ее нагревании.
Таблица 44.1 ЗАКОНЫ ТЕРМОДИНАМИКИ

Глава 45 ПРИМЕРЫ ИЗ ТЕРМОДИНАМИКИ
Когда приходится использовать термодинамику для дела, то оказывается, что она очень трудный и сложный предмет. В этой книге, однако, мы не будем залезать в самые дебри. Эта область особенно интересна для химиков и инженеров, и тем, кому захочется получше познакомиться с ней, следует обратиться к физической химии или инженерной термодинамике. Есть еще ряд хороших справочных книг, в которых эта тема обсуждается более подробно.
Термодинамика сложна потому, что каждое явление она позволяет описывать многими способами. Если нам нужно описать поведение газа, то мы можем исходить из того, что его давление зависит от температуры и объема, а можно предположить, что объем зависит от давления и температуры. То же самое и с внутренней энергией U : можно сказать, что она определяется температурой и объемом, стоит только выбрать именно эти переменные, но можно говорить о зависимости от температуры и давления или от давления и объема и т. д. В предыдущей главе мы познакомились с другой функцией температуры и объема, называемой энтропией S . И теперь ничто не помешает нам построить другие функции этих переменных. Например, функция U - TS тоже зависит от температуры и объема. Таким образом, нам приходится иметь дело с большим количеством разных величин, зависящих от разнообразных комбинаций переменных.
Читать дальше

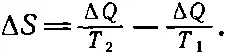 (44.19)
(44.19)





