Пусть n — число молекул пара в единице объема. Это число, естественно, меняется с температурой. С притоком тепла испарение увеличивается. Добавим еще одну величину 1/ V a , равную числу атомов в единице объема, содержащихся в жидкости; мы предполагаем, что в жидкости каждой молекуле отведен вполне определенный объем, поэтому чем больше в жидкости молекул, тем больший объем они занимают. Если V a — объем, отведенный одной молекуле, то число молекул в единичном объеме равно единичному объему, деленному на объем, занимаемый молекулой. Далее, предположим, что между молекулами действуют силы притяжения, удерживающие их внутри жидкости. Иначе нельзя понять, почему происходит конденсация. Итак, предположим, что имеется сила притяжения и существует энергия связи молекулы в жидкости, которая теряется при переходе молекул в пар. Это наводит на мысль, что для перевода какой-нибудь молекулы из жидкости в пар, нужно совершить работу W . Существует определенная разность W между энергией молекулы в жидкости и ее энергией в паре, потому что для переноса молекул в пар мы должны оторвать ее от всех молекул, к которым она притягивается.
Теперь обратимся к общему принципу, по которому отношение числа атомов в единице объема в разных областях равно n 2/n 1=ехр[-( Е 2- E 1/ kT )]. Значит, n —число молекул в единичном объеме пара, деленное на 1/ V a (число молекул в единичном объеме жидкости), равно
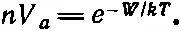 (42.1)
(42.1)
Таково общее правило. Это очень похоже на равновесную атмосферу в поле тяжести, когда низшие слои газа плотнее верхних, потому что для подъема молекулы на высоту h нужна энергия mgh . В жидкости молекулы размещены плотнее, чем в газе, так как их заставляет потесниться энергия «подъема» W , и отношение плотностей равно ехр(- W / kT ).
Это как раз то, что мы хотели вывести — плотность пара изменяется как е в некоторой степени. Показателем служит взятая со знаком минус похожая на энергию величина, деленная на kT . Множители перед экспонентой не особенно интересны, потому что в большинстве случаев плотность пара гораздо меньше плотности жидкости. При этих обстоятельствах, когда мы далеки от критической точки, где плотности почти одинаковы, соотношение плотностей, при котором n много меньше 1/V a, обеспечивается тем, что W много больше kT . Поэтому формулы типа (42.1) интересны только тогда, когда W действительно гораздо больше kT ; в этом случае е возводится в громадную отрицательную степень и если немного изменить Т , то изменится слегка и громадная степень, а это изменение повлечет за собой такие изменения экспоненты, которые будут гораздо важнее возможных изменений предэкспоненциальных множителей. Но отчего бы изменяться таким множителям, как 1/V a? Да оттого, что наше описание приблизительно. Ведь в действительности каждая молекула не имеет определенного объема; при изменении температуры объем V а не остается постоянным — жидкости сжимаются и расширяются. Есть еще и другие мелочи вроде этой, так что действительная ситуация гораздо сложнее. Почти всюду стоят медленно изменяющиеся с температурой множители. В действительности само W медленно изменяется с температурой, потому что при разных температурах молекулам отведены разные объемы, и притяжение должно быть разным, и т. д. Итак, можно прийти к выводу, что поскольку у нас получилась формула, в которой все неизвестным образом изменяется с температурой, то на самом деле формулы никакой и нет. Но если мы знаем, что показатель у экспоненты W / kT заведомо велик, то можно убедиться, что наибольшие изменения кривой плотности пара как функции температуры обусловлены экспоненциальным множителем. Поэтому если мы будем считать W постоянной величиной, а коэффициент 1/V a— почти постоянной, то это будет хорошим приближением вдоль небольшого интервала нашей кривой. Иначе говоря, основные изменения определяются видом функции ехр(-W/kT),
Выходит, что в природе есть много, очень много процессов, для которых характерно взятие энергии взаймы; основным свойством таких процессов является экспоненциальная температурная зависимость: е возводится в отношение взятой с отрицательным знаком энергии к kT . Это полезный факт, но только в тех случаях, когда энергия велика по сравнению с kT , поскольку главная часть изменений с температурой определяется изменением kT , а не величиной постоянных и других сомножителей.
Читать дальше

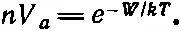 (42.1)
(42.1)




