Можно выкинуть из этого равенства скорости, потому что они равны; если даже специально отметить, что одна из них — скорость молекулы пара, а другая — скорость испаряющейся молекулы, — все равно они одинаковы, ведь мы знаем, что средняя кинетическая энергия обеих молекул (в одном направлении) равна 1/2kT. Но можно сказать: «Нет! Нет! Ведь испаряются только особо быстрые молекулы. Только они приобрели достаточный избыток энергии». Не совсем так, потому что в тот момент, когда эти молекулы выскакивают из жидкости, они теряют этот избыток, преодолевая потенциальную энергию. Поэтому при подходе к поверхности они уже движутся с замедленной скоростью v ! Точно так же обстояло дело с распределением молекулярных скоростей в атмосфере — в нижних слоях молекулы были определенным образом распределены по энергиям. Те из них, которые достигали более высоких слоев, распределялись по энергиям точно так же , потому что медленные молекулы вверх совсем не поднимались, а быстрые, поднявшись, двигались медленнее. Испаряющиеся молекулы распределены по скоростям так же, как молекулы, движущиеся в глубине жидкости — поистине поразительный факт. Во всяком случае, нет смысла пытаться столь строго обсуждать нашу формулу, потому что в ней есть и другие неточности; например, мы рассматривали вероятность отражения молекул от поверхности, а не их конденсации и т. д. Мы имеем дело лишь с грубым описанием скорости испарения и конденсации и видим, естественно, что плотность пара n изменяется так же, как и раньше, но теперь мы понимаем этот процесс много лучше, а раньше писали почти произвольную формулу.
Более глубокое понимание позволит нам выяснить еще кое-что. Например, предположим, что мы откачиваем пар, причем так быстро, что пар удаляется практически с той же быстротой, с какой образуется (если наш насос очень хороший, а испарение происходит медленно). С какой скоростью будет происходить испарение, если температура жидкости Т будет поддерживаться постоянной? Предположим, что мы экспериментально уже измерили равновесную плотность пара и нам известно, сколько молекул в единице объема может быть в равновесии с жидкостью при заданной температуре. Теперь мы хотим узнать скорость испарения жидкости. Хотя мы ограничились лишь грубым анализом испарения, он все же дал нам сведения о числе прибывающих молекул пара, правда, с точностью до неизвестного коэффициента отражения. Поэтому мы можем использовать то обстоятельство, что при равновесии число покидающих пар молекул равно числу прибывающих молекул. Правда, пар откачивается и молекулы могут только покидать жидкость, но если оставить пар в покое, то установится равновесная плотность, при которой число прибывающих в жидкость молекул равно числу испаряющихся. Следовательно, легко видеть, что в этом случае число молекул, покидающих поверхность жидкости за 1 сек , равно произведению неизвестного коэффициента отражения R на число молекул, которые ежесекундно возвращались бы в жидкость, если бы пар не откачивался, потому что именно это число входит в уравнение баланса для испарения при равновесии:
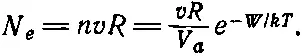 (42.5)
(42.5)
Конечно, легче подсчитать число молекул, переходящих из пара в жидкость, потому что в этом случае не надо ничего предполагать о силах, как это приходилось делать при подсчете числа покидающих жидкость молекул. Проще изменить путь рассуждений.
Можно привести еще один пример часто встречающегося процесса, столь похожего на испарение жидкости, что его даже не придется анализировать отдельно. В сущности, это та же самая задача. В любой радиолампе есть источник электронов — вольфрамовая нить накаливания и положительно заряженная пластинка, притягивающая электроны. Оторвавшийся с поверхности вольфрама электрон немедленно улетает к пластинке. Это — «идеальный» насос, который непрерывно «откачивает» электроны. Возникает вопрос: сколько электронов ежесекундно покидает вольфрамовую проволоку и как их число зависит от температуры? Решение задачи дается той же формулой (42.5), потому что электроны, находящиеся в куске металла, притягиваются ионами или атомами металла. Они, грубо говоря, притягиваются металлом. Чтобы оторвать электрон от металла, надо сообщить ему определенное количество энергии, т. е. затратить для этого работу. Эта работа для разных металлов различна. Фактически она изменяется даже в зависимости от вида поверхности у одного и того же металла, но в целом она составляет несколько электронвольт,—величину, вообще типичную для энергии химических реакций. При этом полезно вспомнить, что разность потенциалов химических элементов, например батареи для магниевой вспышки, которая порождается химическими реакциями, порядка 1 в .
Читать дальше

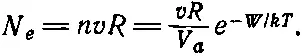 (42.5)
(42.5)




