Давайте рассмотрим сейчас немного подробнее другой способ получения почти аналогичного результата для испарения. Чтобы получить (42.1), мы просто применили всегда справедливое при равновесии правило, но мало что поняли в существе явления. Поэтому невредно попытаться посмотреть детальнее, как происходит испарение. Можно описать его примерно так: молекулы пара непрерывно бомбардируют поверхность жидкости; при ударе они могут либо отскочить от поверхности, либо пробить ее. Что случается чаще, нам неизвестно, может быть, отношение этих исходов равно 50 к 50, а может быть и 10 к 90. Предположим, что поверхность пробивается всегда, потом мы посмотрим, к чему приводит предположение о более прочной поверхности. Тогда в каждый момент будет иметься определенное число атомов, сконденсировавшихся на поверхности жидкости. Число сконденсировавшихся молекул (число молекул, прошедших через площадку единичной площади) равно числу молекул в единице объема n, умноженному на скорость v . Эта скорость молекул связана с температурой; ведь известно, что в среднем 1/ 2mv 2равно 3/ 2 kT . Поэтому v —какая-то средняя скорость. Конечно, нужно еще проинтегрировать по углам и сделать всякого рода усреднения, но результат прямо пропорционален корню из среднего квадрата скорости. Таким образом,
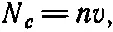 (42.2)
(42.2)
т. е. числу молекул, достигших единичной площадки и сконденсировавшихся.
Но атомы жидкости непрерывно пляшут, и время от времени отдельные атомы выскакивают наружу. Теперь нам нужно выяснить, часто ли это происходит. При равновесии число молекул, выскочивших за 1 сек из жидкости, равно числу молекул, поступивших за это же время на ее поверхность.
Ну, а много ли молекул выскакивает? Чтобы выскочить наружу, молекула должна как-то умудриться приобрести некоторую добавочную энергию, которая окажется больше, чем энергия ее соседок. И этот избыток энергии должен быть довольно большим, ведь наша молекула очень сильно притягивается к остальным молекулам жидкости. Обычно ей так и не удается преодолеть этого сильного притяжения, но иногда при столкновениях на ее долю выпадает излишек энергии. Шансы получить необходимую в нашем случае избыточную энергию W невелики, если W ≫ kT . Действительно, вероятность того, что атом приобретает энергию, большую чем W , равна ехр(- W / kT ). Это общий принцип кинетической теории: шансы призанять энергию W сверх средней энергии равны е , возведенному в степень, показатель которой равен отношению W к kT со знаком минус. Предположим, что некоторым молекулам удалось получить эту энергию. Теперь можно установить, сколько молекул покидает поверхность жидкости за 1 сек . Конечно, получение молекулой нужной энергии еще не означает, что испарение обеспечено. Ведь эта молекула может находиться слишком глубоко в жидкости, а если она даже и находится у поверхности, то может двигаться не туда. Число молекул, покидающих единичную площадку за 1 сек , — это примерно число молекул на единице площади вблизи поверхности, деленное на время, которое требуется молекуле для побега, и умноженное на вероятность ехр(- W / kT ) готовности молекул к побегу, в том смысле, что они уже получили достаточное количество энергии.
Предположим, что каждая молекула на поверхности жидкости занимает определенную площадку площади А . Тогда число молекул на единице поверхности жидкости равно 1/ А . А много ли молекуле нужно времени, чтобы совершить свой побег? Если молекулы движутся с определенной средней скоростью v и должны пройти расстояние, равное, скажем, диаметру молекулы D (толщине наружного слоя), то время, нужное для преодоления этого расстояния, и есть время побега, если только молекула обладает достаточной энергией. Это время равно D / v . Таким образом, число испаряющихся молекул приблизительно равно
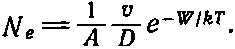 (42.3)
(42.3)
Заметим, что произведение площади каждой молекулы на толщину слоя приблизительно равно объему V a , отведенному каждой молекуле. Итак, для получения равновесия мы должны иметь N c = N e , или
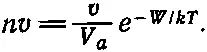 (42.4)
(42.4)
Читать дальше

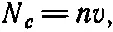 (42.2)
(42.2)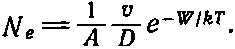 (42.3)
(42.3)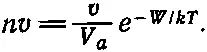 (42.4)
(42.4)




