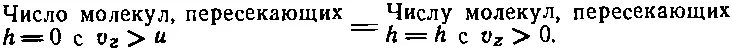
Но число молекул, пересекающих h с любой скоростью, большей нуля, меньше числа молекул, пересекающих нижний уровень с любой скоростью, большей нуля, хотя бы потому, что внизу больше атомов. Вот и все, что нам нужно. Мы уже знаем, что распределение молекул по скоростям на всех высотах одинаково, ведь мы уже выяснили, что температура во всей атмосфере одинакова. Но поскольку распределение скоростей всюду одинаково и число атомов, пересекающих нижний уровень, больше, то ясно, что отношение n >0( h ) (числа атомов, пересекающих высоту h с положительной скоростью) и n >0(0) (числа атомов, пересекающих с положительной скоростью высоту 0) равно отношению плотностей на этих высотах, т. е. ехр(— mgh / kT ). Но n >0( h )= h > u (0), поэтому
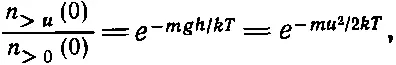
поскольку 1/ 2 mu 2= mgh . Теперь скажем это своими словами: число молекул, пересекающих за 1 сек единичную площадь на высоте 0 с вертикальной составляющей скорости, превышающей u , равно произведению числа молекул, пересекающих эту площадку со скоростью, большей нуля, на ехр(- mu 2/2 kT ).
Это верно не только для произвольной высоты 0, но и для любой другой высоты, поэтому распределение по скоростям одинаково повсюду ! (Окончательный результат не включает высоты h , она появляется только в промежуточных рассуждениях.) Это общая теорема о распределении по скоростям. В ней утверждается, что если в столбе газа просверлить крохотную дырочку, ну совсем малюсенькую, так что столкновения там будут редки и длина пробега молекул между столкновениями будет много больше диаметра дырочки, то молекулы будут вылетать из нее с разными скоростями, но доля частиц, вылетающих со скоростью, превышающей и , равна ехр(- mu 2/2 kT ).
Теперь вернемся к вопросу о том, можно ли пренебрегать столкновениями. Почему это не имеет значения? Мы могли бы повторить все наши доводы, используя не конечную высоту h , а бесконечно малую высоту h , столь малую, что для столкновений между высотами 0 и h было бы слишком мало места. Но это не обязательно: наши доводы, очевидно, основаны лишь на анализе значений энергий и на сохранении энергии; при столкновениях же происходит обмен энергиями среди молекул. Но нам довольно безразлично, следим ли мы за одной и той же молекулой, раз происходит лишь обмен энергиями с другой молекулой. И получается, что если мы даже сделаем это достаточно тщательно (а такую работу тщательно проделать, конечно, труднее), то результат будет тот же.
Интересно, что найденное нами распределение по скоростям имеет вид
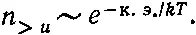 (40.4)
(40.4)
Этот способ описания распределения по скоростям —когда подсчитывается число молекул, проходящих через выделенную площадку с заданной минимальной z-составляющей скорости,— отнюдь не самый удобный. Например, чаще хотят знать, сколько молекул в заданном объеме газа движется, имея z -составляющую скорости между двумя заданными значениями, а это, конечно, из (40.4) сразу не получишь. Поэтому придадим нашей формуле удобную форму, хотя то, что мы получили, — это весьма общий результат. Заметим, что невозможно утверждать, что любая молекула в точности обладает той или иной наперед заданной скоростью ; ни одна из них не движется со скоростью, в точности равной 1,7962899173 м / сек . Итак, чтобы придать нашему утверждению какой-то смысл, мы должны спросить, сколько молекул можно найти в заданном интервале скоростей. Нам придется говорить о том, как часто встречаются скорости в интервале между 1,796 и 1,797 и т. п. Выражаясь математически, пусть f ( u ) du будет долей всех молекул, чьи скорости заключены в промежутке u и u + du, или , что то же самое (если du бесконечно мало), долей всех молекул, имеющих скорость и с точностью до du . На фиг. 40.5 представлена возможная форма функции f(u), а заштрихованная часть ширины du и средней высоты f ( u ) — это доля молекул f ( u ) du .
Таким образом, отношение площади заштрихованного участка ко всей площади под кривой равно относительному числу молекул со скоростью и внутри отрезка du .
Читать дальше

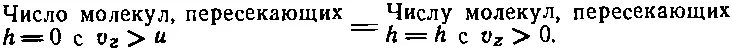
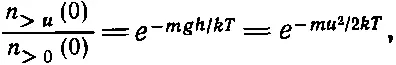
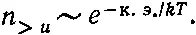 (40.4)
(40.4)




