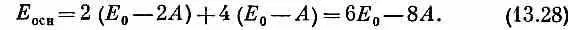В состоянии наименьшей энергии оба электрона будут в наинизшем состоянии с противоположными спинами. Энергия «лишней» связи в молекуле этилена поэтому равна 2 (Е 0 -А), если пренебречь взаимодействием между двумя электронами. Теперь вернемся к бензолу. У каждого из двух состояний на фиг. 13.3 есть три двойные связи. И каждая из них очень похожа на связь в этилене и дает вклад в энергию 2 (Е 0 -А), где теперь Е 0 — уже энергия, необходимая, чтобы поместить электрон в бензоле на нужное место, а А — амплитуда переброса его в соседнее место. Значит, энергия должна быть равна примерно 6 (Е 0 -А). Но когда мы раньше изучали бензол, то пришли к выводу, что его энергия ниже энергии структуры с тремя двойными связями. Посмотрим, получится ли теперь, с нашей новой точки зрения, энергия бензола ниже, чем у трех двойных связей.
Начинаем с шестикратно ионизованного бензольного кольца. Добавляем один электрон. Теперь у нас система с шестью состояниями. Мы пока еще не решали таких систем, но знаем, что нужно делать. Можно написать шесть уравнений для шести амплитуд и т. д. Но не лучше ли сберечь свои силы, ведь мы уже решили эту задачу, исследуя электрон в бесконечной цепочке атомов. Конечно, бензол — не бесконечная цепочка, шесть мест для атомов в нем расположены по кругу. Но представьте, что мы разняли кольцо в цепь и пронумеровали атомы вдоль цепи числами от 1 до 6. В бесконечной линии следующее место имело бы номер 7, но если мы условимся, что оно совпадает с местом номер 1 и т. д., то все окажется в точности похожим на бензольное кольцо. Иными словами, мы можем взять решение для бесконечной линии с добавочным требованием, чтобы решение было периодичным с периодом длиной в шесть атомов. Согласно гл. 11, электрон на прямой обладает состояниями определенной энергии, когда амплитуда того, что он окажется в некотором месте х n , равна  . При каждом k энергия равна
. При каждом k энергия равна
E = E 0 - 2 Acoskb . (13.25)
Теперь из этих решений нам нужно оставить только такие, которые через каждые 6 атомов повторяются. Разберем сперва общий случай, когда в кольце N атомов. Если решение должно иметь период в N атомных расстояний, то e ikbN должна быть равна единице, или kbN должна быть кратна 2p. Если s — любое целое число, то наше условие имеет вид
kbN =2 p s . (13.26)
Мы раньше видели, что нет смысла брать k вне пределов ±p/ b . Это означает, что мы получим все мыслимые состояния, беря значения s в пределах ± N /2.
Стало быть, мы приходим к тому, что у N -атомного кольца имеется N состояний определенной энергии и их волновые числа k s даются числами
k s =2ps/ Nb . (13.27)
Каждое состояние имеет энергию (13.25). Получается линейчатый спектр возможных уровней энергий. Спектр для бензола ( N =6) показан на фиг. 13.8, б. (Числа в скобках указывают число различных состояний с одинаковой энергией.)
Есть наглядный способ изобразить эти шесть уровней энергии. Он показан на фиг. 13.8, а. Вообразим круг с центром на одном уровне с Е 0 и с радиусом 2А. Если мы отложим, начиная снизу, шесть равных дуг (под углами, считая от нижней точки, k s b = 2 p s / N , или 2ps/6 для бензола), то высоты точек круга будут решениями (13.25). Шесть точек представляют шесть возможных состояний. Низший уровень энергии придется на Е 0 - 2А ; дальше идут два состояния с одинаковой энергией Е 0 - А и т. д. Это возможные состояния одного электрона. Если электронов не один, а больше, то в каждое состояние может попасть по два электрона с противоположными спинами.
У молекулы бензола надо здесь разместить шесть электронов. Если состояние основное, то они должны попасть в наинизшие возможные энергетические состояния — пара в s=0, пара в s=+1 и пара в s =-1. Согласно приближению независимых частиц, энергия основного состояния равна
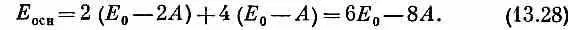
Она действительно оказывается меньше, чем у трех отдельных двойных связей,— на 2А.
Сравнив энергию бензола с энергией этилена, можно определить А. Эта величина оказывается равной 0,8 эв, или в единицах, которые нравятся химикам, 18 ккал/моль.
Читать дальше

 . При каждом k энергия равна
. При каждом k энергия равна