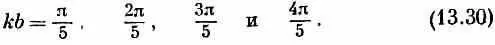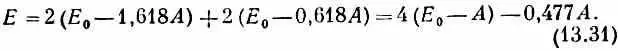где s — целое число между 1 и N. (Берутся только положительные k , потому что каждое решение содержит и + k , и - k ; перемена знака k опять дает то же состояние.) Для молекулы бутадиена N =4, так что имеется четверка состояний с
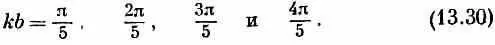
Уровни энергии можно теперь представить, пользуясь круговой диаграммой, похожей на бензольную. На сей раз возьмем полукруг, деленный на пять равных частей (фиг. 13.11).
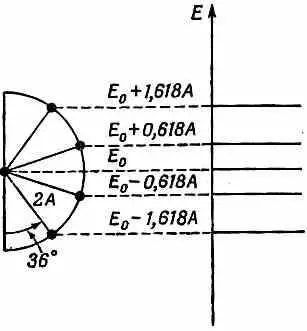
Фиг. 13.11. Энергетические уровни бутадиена.
Точка внизу отвечает s=0, что не дает какого-либо состояния. То же самое справедливо для точки наверху, отвечающей s= N +1. Оставшиеся четыре точки дают четверку разрешенных энергий. Имеется четыре стационарных состояния, чего и следовало ожидать, судя по четырем базисным состояниям. В круговой диаграмме углы равны p/5, или 36°. Наинизшая энергия оказывается равной Е 0 — 1,618 A . (Каких только чудес не бывает в математике! Золотое сечение греков дает нам наинизшее энергетическое состояние молекулы бутадиена, как это следует из
нашей теории!)
Теперь уже ясно, как меняется энергия молекулы бутадиена, когда в нее вводят четверку электронов. Эта четверка заполнит два нижних уровня — каждый будет заполнен парой электронов с противоположными спинами. Полная энергия будет равна
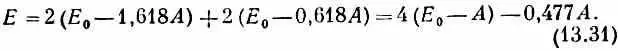
Это выглядит вполне разумно. Энергия чуть пониже, чем просто у двух двойных связей, но связь не так сильна, как в бензоле. Во всяком случае, именно так химик анализирует некоторые органические молекулы.
Но в его распоряжении есть не только энергии, но и амплитуды вероятности. Зная амплитуды для каждого состояния и зная, какие состояния заполнены, он может сообщить нам, какова вероятность нахождения электрона в каком-нибудь месте молекулы. Те места, где пребывание электрона более вероятно, вступают в игру при таких химических замещениях, которые требуют, чтобы электрон обслуживал и другую группу атомов. Другие же места молекулы участвуют в таких замещениях, при которых молекула имеет тенденцию передать системе еще один электрон.
Подобные же идеи могут помочь нам получить правильное представление даже о таких сложных молекулах, как хлорофилл, один из вариантов которого показан на фиг. 13.12.
Фиг. 13.12. Молекула хлорофилла.
Обратите внимание, что двойные и одиночные связи образуют длинное замкнутое кольцо с двадцатью интервалами.
Лишние электроны двойных связей могут бегать по этому кольцу. При помощи метода независимых частиц можно получить всю совокупность энергетических уровней. От переходов между этими уровнями возникают сильные линии поглощения, которые лежат в видимой части спектра и придают этой молекуле ее густой цвет. И другие сложные молекулы, такие, как ксантофилл, от которого листья получают красную окраску, можно изучить таким же точно способом.
В органической химии при работе с подобного рода теорией используют еще одну идею. Она, пожалуй, самая удачная из всех (или по крайней мере в определенном смысле самая точная). Она отвечает на такой вопрос: в каких случаях получается особенно прочная химическая связь? Ответ очень интересен. Возьмем вначале для примера бензол и представим ряд событий, которые произойдут, если мы начнем с шестикратно ионизованной молекулы и примемся добавлять новые и новые электроны. Тогда нужно будет говорить о различных ионах бензола — отрицательных и положительных. Изобразим энергию иона (или нейтральной молекулы) как функцию числа электронов. Если мы примем Е 0=0 (мы не знаем, чему равно E 0), то получим кривую, показанную на фиг. 13.13.
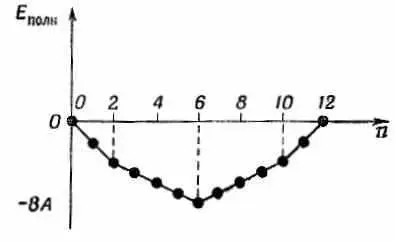
Фиг. 18.13. Сумма всех энергий электронов, когда нижние состояния на фиг. 13.8 заполнены n электронами (принято E 0=0).
Читать дальше