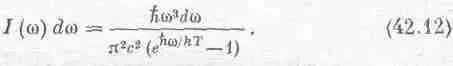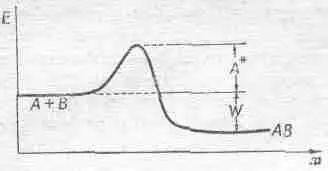
Фиг. 42.1. Соотношение энергий в реакции А + В ® АВ.
Таким образом, скорость перехода АВ в А и В пропорциональна произведению n АВ — начальному числу молекул АВ на
ехр[- (W+A*)/kT]:
R r =c'n AB e -(W+A*)/kT) . (42.11)
Постоянная с' складывается из объема атомов и частоты столкновений; ее можно получить, как и в случае испарения,
перемножая площадь и толщину слоя, но сейчас мы этого делать не будем. Сейчас нас больше интересует тот факт, что, когда эти скорости равны, их отношение равно единице. Это говорит о том, что, как и раньше, ( n а n в / n ав ) = c ехр(- W / kT ), где с содержит сечения, скорости и другие множители, не зависящие от чисел п. Интересно, что скорость реакции по-прежнему изменяется как ехр(-const/ kT ), хотя эта постоянная уже не имеет никакого отношения к той, с которой мы встречались в задаче о концентрациях; энергия активации А* сильно отличается от энергии W . Энергия W регулирует пропорции А, В и АВ, при которых устанавливается равновесие, но если нам захочется узнать, быстро ли А + В переходит в АВ, то это уже к равновесию отношения не имеет, и появляется уже другая энергия, энергия активации, которая с помощью экспоненты управляет скоростью реакции.
Кроме того, A* не является фундаментальной постоянной, как W . Предположим, что реакция происходит на поверхности стены, или на какой-нибудь другой поверхности, тогда А и В могут растечься по ней так, что объединение в А В будет для них более легким делом. Иначе говоря, сквозь гору можно прорыть «туннель» или срыть вершину горы. В силу сохранения энергии, по какому бы пути мы ни шли, результат будет один: из А и В получится АВ, так что разность энергий W не зависит от пути, по которому идет реакция, однако энергия активации А* очень сильно зависит от этого пути. Вот почему скорости химических реакций столь чувствительны к внешним условиям. Можно изменить скорость реакции, изменив поверхность, с которой соприкасаются реактивы, можно изготовить «набор бочонков» и подбирать с его помощью любые скорости, если они зависят от свойств поверхности. Можно внести в среду, в которой происходит реакция, третий предмет; это также может сильно изменить скорость реакции, такие вещества при незначительном изменении А* иногда чрезвычайно влияют на скорость реакции; их называют катализаторами. Реакции может практически не быть совсем, потому что А* слишком велика для заданной температуры, но если добавить это специальное вещество — катализатор, то реакция протекает очень быстро, потому что А* уменьшается.
Между прочим, эта реакция А плюс В, дающая АВ, доставляет немало волнений. Ведь невозможно сохранить сразу и энергию, и импульс, пытаясь подогнать два предмета друг к другу, чтобы сделать из них один более устойчивый. Следовательно, необходим по крайней мере третий предмет С и реальная реакция выглядит гораздо сложнее. Скорость прямого процесса должна содержать произведение n A n B n C , и можно подумать, что наша формула становится неверной, но это не так! Если мы начнем искать скорость развала АВ, то выясним, что этой молекуле еще надо столкнуться с С, поэтому скорость обратной реакции пропорциональна n AB n C и из формулы для равновесных концентраций n C выпадает. Правильность закона равновесия (42.9), который мы написали прежде всего, абсолютно гарантирована независимо от любого возможного механизма реакции!
§ 5. Законы излучения Эйнштейна
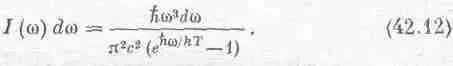
Обратимся теперь к интересной задаче, похожей на только что описанную и связанную с законом излучения черного тела. В предыдущей главе мы разбирали вывод закона распределения излучения в полости по способу Планка, рассматривая излучение осциллятора. Осциллятор обладает определенной средней энергией, а раз он осциллирует, то должен и излучать и накачивать излучение в полость, пока она не заполнится как раз таким количеством излучения, которое нужно для поддержания равновесия между излучением и поглощением. Рассуждая таким образом, мы нашли, что интенсивность излучения частоты w задается формулой
Читать дальше