Adicionalmente, puede encontrarse una pequeña cantidad de líquido intracavitario (hidrómetra) debido a la estenosis del canal endocervical por atrofia (Figs. 2.28 y 2.29). Este hallazgo suele ser pasajero y no es signo de mal pronóstico.
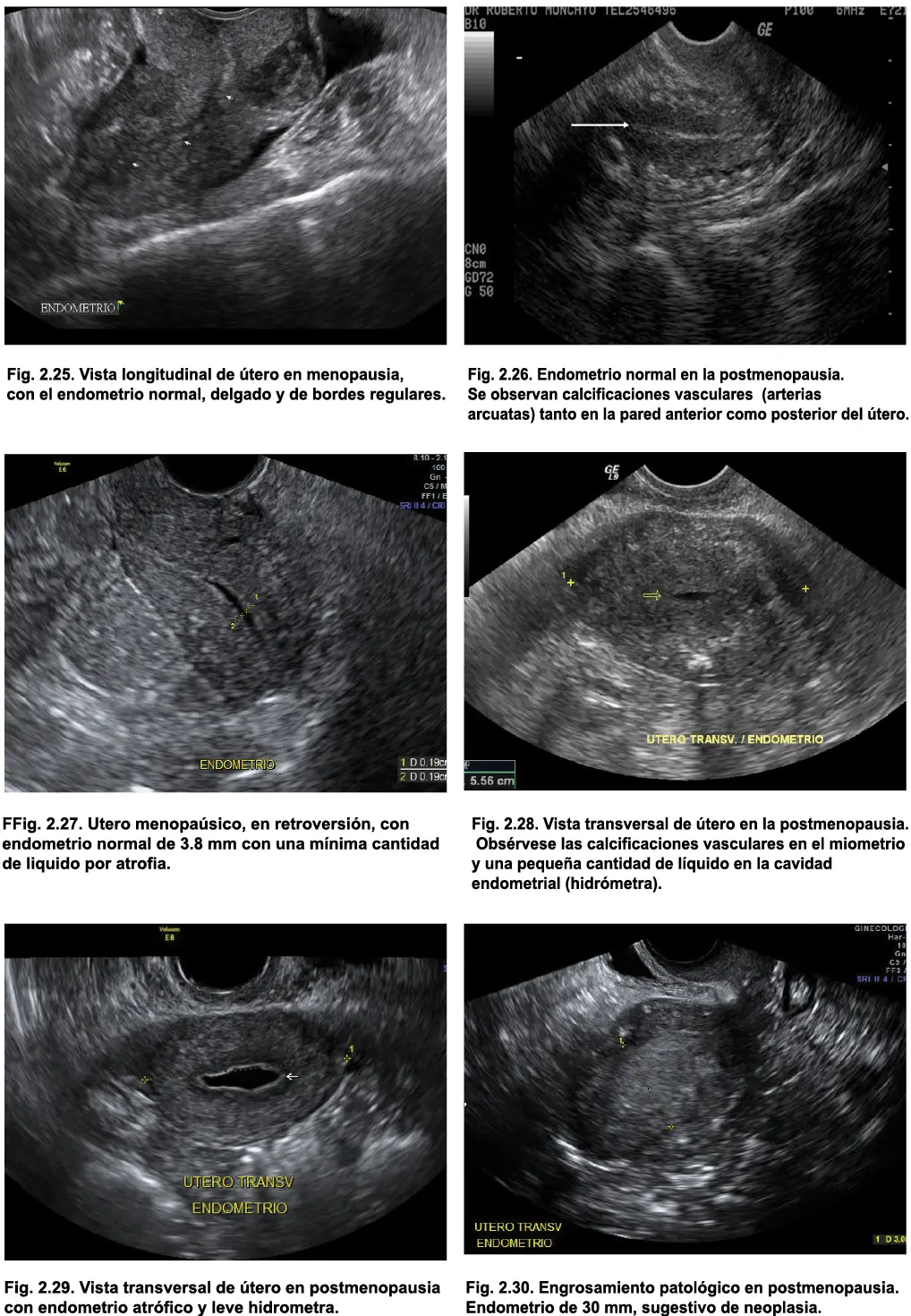
Tabla 2.1.- Grosor normal máximo endometrial por ecografía
| Fase menstrual |
4 mm |
| Fase proliferativa temprana |
8 mm |
| Faseproliferativatardía (periovulatoria) |
11mm |
| Fase secretora (premenstrual) |
16 mm |
| Posmenopausia |
4 mm |
| Posmenopausia con terapia hormonal |
8 mm |
| Posparto |
20 mm |
Bibliografía
Breijer M, Peeters J, Opmeer B, Clark T, Verheijen M, Mol W, Timmermans A. “Capacity of endometrial thickness measurement to diagnose endometria carcinoma in asymptomatic postmenopausal women: a systematic review and metanalysis. Ultrasound”, in Obstetrics & Gynecology 2012: 40(6), 621–629.
Corbacioglu - Esmer A, Akbayir O, Goksedef BP, Gunduz N, Kisacık S, Dagdeviren H, Guraslan B, Ark C. “¿Is there an appropriate cutoff age for sampling the endometrium in postmenopausal bleeding?”, Gynecol Obstet Invest. 2014, 77(1):40-4.
Fleischer AC. Sonographic assessment of endometrial disorders. Semin Ultrasound CT MR, 1999; 20:259 –266.
Hall DA, Yoder IC. “Ultrasound evaluation of the uterus”, en Callen PW editor,. Ultrasonography in obstetrics and gynecology. 3rd. ed. Philadelphia, Pa: Saunders, 1994; 586 – 614.
Lavery JP, Gadwood KA. “Postpartum ultrasonography”, en Callen PW, ed. Ultrasonography in obstetrics and gynecology, 3rd ed. Philadelphia, Pa, Saunders, 1994, 509 –519.
Nalaboff K, Pellerito J, Ben-Levi E. Imaging of the endometrium; disease and normal variants. RadioGraphics 2001, 21:1409 –1424
Siegel MJ, Surratt JT. Pediatric Gynecologic Imaging.Obstet Gynecol Clin North Am 1992, 19, 103–127.
Wachsberg R, Kurtz A. “Gas within endometrial cavity at postpartum US: a normal finding after spontaneous vaginal delivery”, en Radiology 1992; 183:431– 433.
3 Hiperplasia de endometrio
Dr. José Julio Serrano/ Dr. Roberto Moncayo
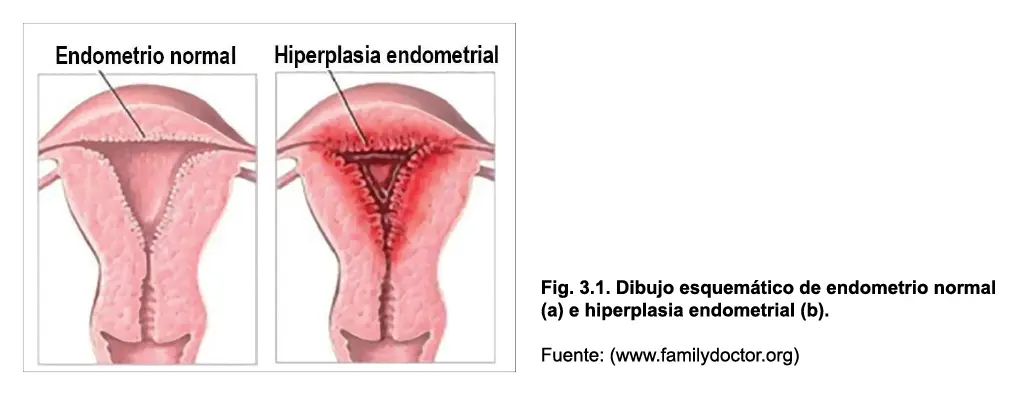
La hiperplasia endometrial se define como una proliferación de glándulas de forma y tamaño irregular, con un incremento en la relación glándula/estroma. Este proceso suele ser difuso, pero no siempre afecta a toda la mucosa, y se relaciona con el estímulo prolongado de estrógenos no compensado con gestágenos, correspondiendo a una lesión premaligna que puede convertirse en cáncer endometrial en el 1- 29% de los casos, dependiendo de la presencia o no de atipias celulares (Sanhueza, 2008).
Existen más de veinte clasificaciones histológicas de hiperplasia endometrial que intentan evaluar y establecer una correspondencia entre la morfología de la lesión y su capacidad de progresión. En 1992, la International Society of Gynecological Pathologists y el Comité de Tumores Endometriales de la OMS, decidieron adoptar la clasificación de hiperplasia simple, compleja y atípica, con base en la apariencia, aglomeración y la presencia de atipia en el epitelio glandular, como originalmente fue definida por Kurman 1985 (Kurman et al., 1985).
Utilizando esta clasificación, el riesgo de progresión a carcinoma de endometrio (tabla 3.1) es de 1% para hiperplasia simple sin atipia, 3% para hiperplasia compleja sin atipia y 23-29% para hiperplasias con atipia (Kumar et al., 2004).
Tabla 3.1.- Hiperplasia endometrial y Carcinoma de Endometrio
| Tipo de hiperplasia |
Presencia de atipia |
% Progresión a adenocarcinoma |
| Simple |
Sin atipia |
1 |
| Con atipia |
8 |
| Compleja |
Sin atipia |
3 |
| Con atipia |
29 |
| Tabla elaborada por el autor con datos de Robert L. Giuntoli, II, Howard A Zacur,Barbara Goff. Rochelle L Garcia, Sandy J Falk, M UpToDate 2015 |
En países como EEUU, la incidencia de hiperplasia endometrial es de 58/100.000 mujeres para hiperplasia simple sin atipia, 63/100.000 para hiperplasia compleja sin atipia, y 17/100.000 para hiperplasia con atipia. El rango de edad más frecuente para el diagnóstico de esta enfermedad, es entre los 41 y los 50 años (61% de casos). Sin embargo, la incidencia de hiperplasia con atipia es más frecuente en el grupo de 60 hasta 64 años (García-Ayala 2010).
Los factores de riesgo más importantes para esta patología son la obesidad, la diabetes y el tratamiento hormonal estrogénico sin oposición de gestágenos o producción endógena excesiva de estrógenos como en el ovario poliquístico (Moroni et al., 2002). El principal síntoma es el sangrado uterino anormal. Según Reed et al., 2009, en mujeres asintomáticas, con un patrón de sangrado normal, la prevalencia de hiperplasia de endometrio es muy baja (0.5 - 5% sin atipia y 0.1% con atipia). Por ello, no se recomienda realizar pruebas de cribado para esta enfermedad.
Signos ecográficos
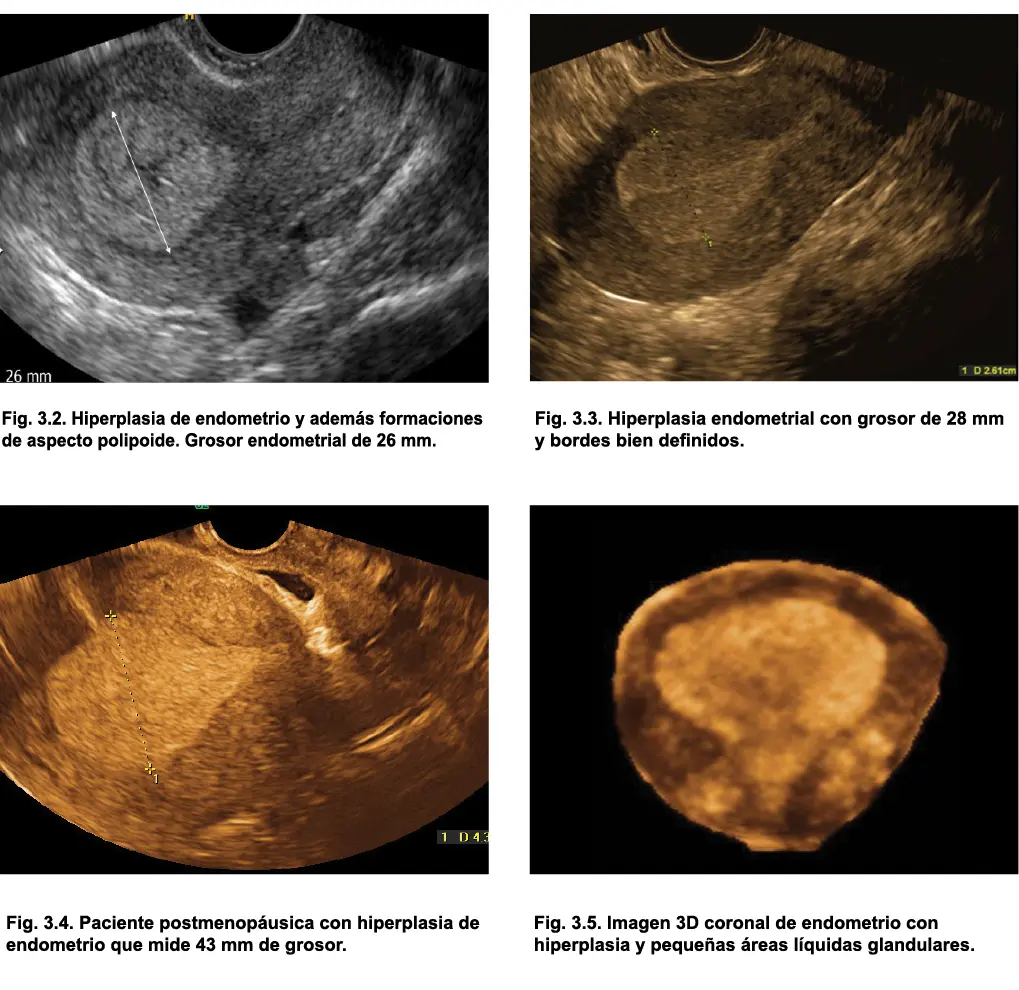
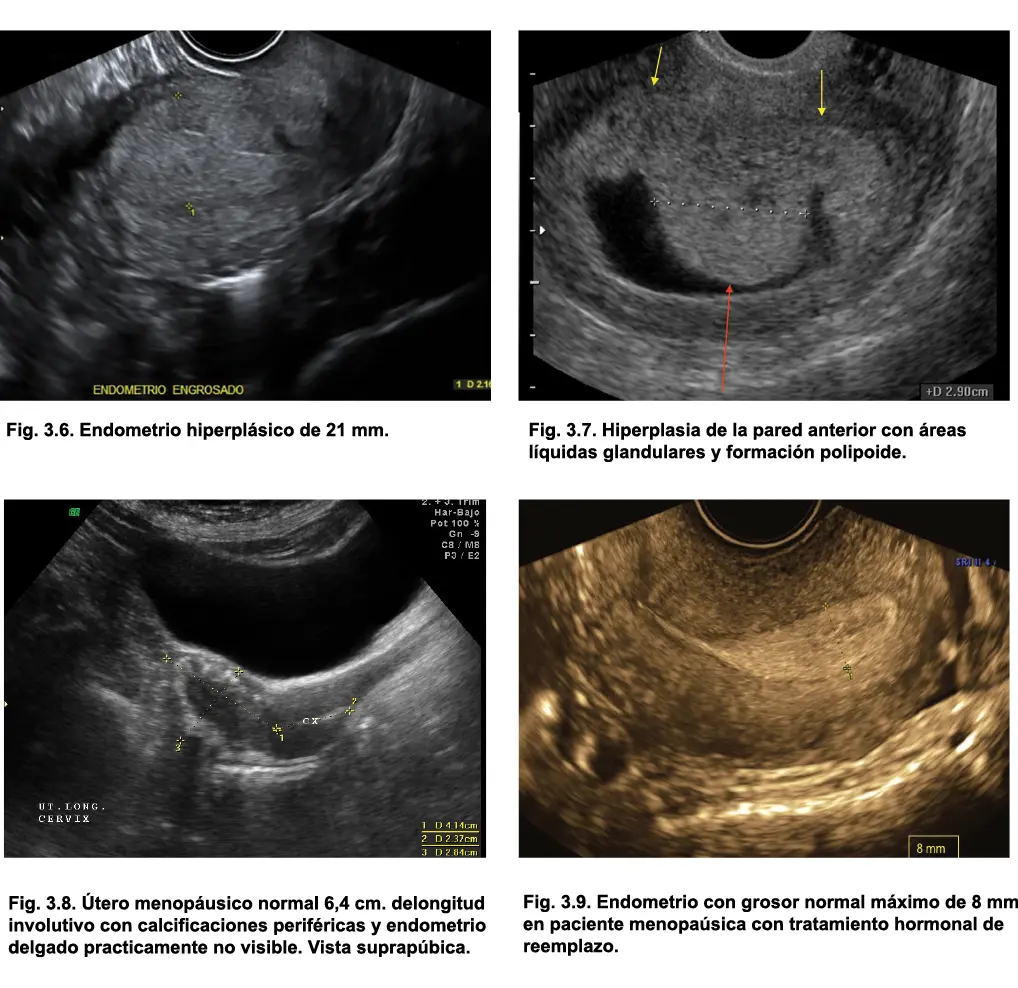
Comunmente, el diagnóstico de hiperplasia se establece cuando encontramos en mujeres de edad fértil, un grosor endometrial superior a 16 mm (figs. 3.2, 3.3, 3.4, 3.5, 3.6 y 3.7); sin embargo, estudios recientes concluyen que no puede establecerse un punto de corte exacto de grosor endometrial que determine el riesgo de hiperplasia, sino que debe tenerse en cuenta la clínica de sangrado irregular y factores de riesgo concomitantes (Carbacioglu et al., 2014). Usualmente, en la hiperplasia endometrial, se observan áreas circulares anecoicas internas correspondientes a glándulas endometriales (fig.s 3.5 y 3.7) también hiperplásicas.
Para las mujeres postmenopáusicas sin tratamiento hormonal, el grosor endometrial ecográfico máximo establecido es de 4 mm (fig. 3.8) y para quienes tienen tratamiento hormonal de reemplazo, hasta 8 mm (fig. 3.9). Es importante recalcar que en esta patología se mantiene la integridad de la interfase endometrio-miometrio, con bordes bien definidos.
En el tamizaje de mujeres postmenopáusicas con sangrado vaginal, un endometrio de 3 mm de grosor tiene una sensibilidad de 97.5% y especificidad de 45.3% para esta patología. Si el grosor es de 4 mm, la sensibilidad es de 94.1% y especificidad de 66.8% . Por último, para un grosor endometrial de 5mm, la sensibilidad es de 93.5% de sensibilidad y 74% de especificidad. (Wong et al, 2016).
Con estos datos observamos que, cuanto menor el grosor endometrial establecido mayor sensibilidad pero menor especificidad, es decir aumentamos la tasa de detección de la enfermedad pero con mayores tasas de falsos positivos.
En pacientes postmenopáusicas asintomáticas, se estableció que un grosor endometrial de 8 mm tiene una sensibilidad del 100% y especificidad de 24% para diagnóstico de hiperplasia. (Park et al, 2019)
En el año 2011 el Collaborative Trial of Cancer Screening de UK (UKTOCS) en un estudio realizado en 37.038 mujeres postmenopásicas asintomáticas; establecieron que un grosor endometrial de 6.75 mm tiene una sensibilidad de 84.3% y especificidad de 89.9% para el diagnóstico de hiperplasia (Jacobs et al, 2011).
Читать дальше
















