• Eine familiäre Häufung ist nachgewiesen, die MS gehört zur Gruppe der komplexen genetischen Erkrankungen (weder Mendel’scher noch mitochondrialer Erbgang).
• Die Konkordanzrate ist bei monozygoten Zwillingen mit 25–31 % deutlich höher als bei dizygoten mit 5 %.
• Die MS ist genetisch verknüpft mit:
– HLA assoziierten Genen: HLA- DRB1, HLA- DRB5*0101, HLA- DQA1*0101, HLA- DQB1*0602, HLA- C
– Nicht HLA assoziierten Genen: IL7R, CD25, Tyk, LAG3, PRKCA, PD1
Faktisch alle bislang mit der MS in Verbindung gebrachten genetischen Risikofaktoren sind Gene des Immunsystems.
Die entmarkte Plaque ist das Hauptcharakteristikum der MS (Frohman et al. 2006b). Innerhalb der Plaques kommt es zu einer Zerstörung des Myelins und/oder der Oligodendrozyten bei relativer Erhaltung der Axone und der Ausbildung von Narbengewebe (Lassmann 1998). Sie sind begleitet von einer Entzündungsreaktion. Das entzündliche Infiltrat setzt sich hauptsächlich aus Lymphozyten und Makrophagen zusammen, die überwiegend perivaskulär liegen. Die Zusammensetzung des entzündlichen Infiltrats ist vom Stadium der Demyelinisierungsaktivität abhängig. Plaques bei akuter und früher MS weisen eine ausgedehnte Remyelinisierung auf (»shadow plaques«), während das Remyelinisierungspotenzial bei chronischen MS-Plaques weitaus geringer ist (Chang et al. 2002). In MS-Läsionen finden sich ganz unterschiedliche Veränderungen hinsichtlich der Myelin- und Oligodendrozytenschädigung (Patrikios et al. 2006).
Bei Patienten mit schubförmiger MS finden sich vornehmlich fokale entmarkende Läsionen in der weißen Substanz. Im Gegensatz dazu findet sich bei primär und sekundär chronischen Verlaufsformen eine diffuse Schädigung der »normal appearing white matter« und eine kortikale Demyelinisierung (Kutzelnigg et al. 2007). Die Affektion der grauen Substanz gewinnt zunehmend Bedeutung in der Einschätzung der Progressionsdynamik sowie der kortikal bedingten Pathologie bei MS-Patienten (Miller et al. 2005a und b). Dabei finden sich bei den chronischen Formen eine starke mikrogliale Aktivierung und diffuse axonale Schädigungen mit Beteiligung des gesamten Gehirns. In chronischen Verlaufsformen der MS finden sich Hinweise auf ektopes lymphoides Gewebe (B-Zell-Follikel) in den Meningen (Serafini et al. 2004).
Die unterschiedlichen histopathologischen Befunde lassen sich mit einem einheitlichen Pathomechanismus nur schwer erklären. Es wird derzeit angenommen, dass verschiedene immunologische und möglicherweise toxische Mechanismen für die unterschiedlichen histologischen Muster und Stadien der Erkrankung verantwortlich sind (Barnett und Prineas 2004; Trebst et al. 2006).
Die frühen Symptome der MS sind vermutlich das Resultat axonaler Demyelinisierungen, die zur Verlangsamung oder Blockade der Nervenleitung führen. Die Remission wird dem Rückgang des entzündlichen Ödems zugesprochen sowie einer partiellen Remyelinisierung. Weiterhin gibt es eine Reihe von Molekülen (z. B. Zytokine, NO, pH), die die axonale Funktion stören können (Friese et al. 2014). Die Wiederherstellung der Nervenfunktion könnte auch durch die Neuverteilung von Natriumkanälen in den Segmenten der Demyelinisierung mitbedingt sein (Waxman 2008). Wiederholte Schübe führen dann zur irreversiblen Axonenschädigung, zu Gliosenarben und zum Verbrauch von Oligodendrozytenvorläuferzellen. Sie sind verantwortlich für die Progression der neurologischen Symptomatik. Interessanterweise bestätigen jüngst Studien die bereits in den Erstbeschreibungen der Erkrankung nachgewiesenen axonalen Schäden, die auch schon in sehr frühen Phasen der MS nachzuweisen sind (Trapp et al. 1998; Kuhlmann et al. 2002) und die mit dem Ausmaß der Entzündung in jedem Stadium der Erkrankung korrelieren (Frischer et al. 2009).
3.1 Immunologische Grundlagen des Zentralen Nervensystems
Lange Zeit wurde das ZNS als immunprivilegiertes Organ betrachtet, eine Ansicht, die in den zurückliegenden Jahren immer stärker hinterfragt wurde (Cserr et al. 1992; Negi und Das 2018). Das ZNS enthält ein Reservoir verschiedener Zellen, die nach entsprechender Stimulation spezifische Moleküle exprimieren, die eine Interaktion mit immunkompetenten Zellen ermöglichen bzw. zu einer Freisetzung von Zytokinen oder chemotaktischen Zytokinen, sog. Chemokinen, führen (  Abb. 3.1). Eine Schädigung des ZNS-Gewebes induziert die Aktivierung residenter Immunzellen (Mikroglia und Astrozyten ) im ZNS, mit konsekutiver Aufregulation sog. MHC (Major Histocompatibility Complex)-Moleküle (beim Menschen auch HLA-Moleküle genannt), die für die Antigenpräsentation wichtig sind sowie zugehörige kostimulatorische Moleküle (
Abb. 3.1). Eine Schädigung des ZNS-Gewebes induziert die Aktivierung residenter Immunzellen (Mikroglia und Astrozyten ) im ZNS, mit konsekutiver Aufregulation sog. MHC (Major Histocompatibility Complex)-Moleküle (beim Menschen auch HLA-Moleküle genannt), die für die Antigenpräsentation wichtig sind sowie zugehörige kostimulatorische Moleküle (  Abb. 3.3). Darüber hinaus
Abb. 3.3). Darüber hinaus
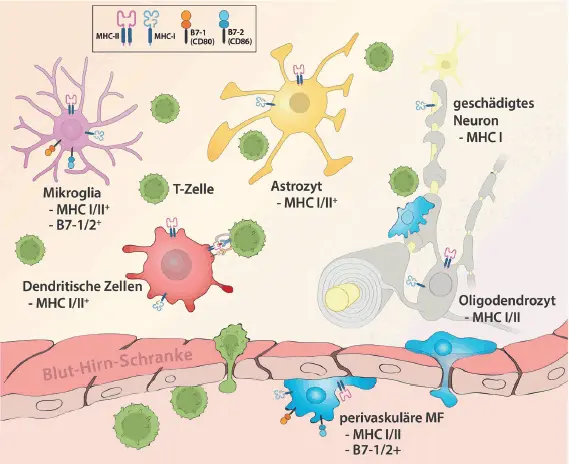
Abb. 3.1: Das zentrale Nervensystem beinhaltet zahlreiche zelluläre Komponenten, die ein lokales Immunmilieu formen. Unter verschiedenen Umständen können alle aufgezeigten Zellpopulationen MHC-Moleküle exprimieren, somit Antigene präsentieren und eine Immunantwort induzieren. Perivaskulär lokalisierte Makrophagen (exprimieren auch kostimulatorische Moleküle wie B7-1 und B7-2) (© Heike Blum).
führt eine Gewebeschädigung zur Freisetzung von Botenstoffen mit nachfolgender Rekrutierung immunkompetenter Zellen aus dem Blut in das ZNS. Mikrogliazellen sind somit wichtig für die Entstehung und Erhaltung eines entzündlichen Milieus im ZNS. Die rekrutierten, invadierenden Zellen sind Lymphozyten, Monozyten und dendritische Zellen, letztere spielen gerade bei der Reaktivierung invadierender T-Zellen eine entscheidende Rolle (Hemmer et al. 2005; Greter et al. 2005;  Abb. 3.4). Die Invasion mononukleärer Entzündungszellen aus der Peripherie, also aus dem Blutstrom, wird begleitet von einer zunehmenden Durchlässigkeit der Blut-Hirn-Schranke , was einerseits den Einstrom zellulärer Komponenten in das ZNS erleichtert und andererseits auch den Übertritt größerer Moleküle aus dem Blut in das ZNS-Gewebe hinein ermöglicht. Der Wirkmechanismus von Natalizumab beruht in der Blockade des Übertritts von CD4 +-T-Zellen (
Abb. 3.4). Die Invasion mononukleärer Entzündungszellen aus der Peripherie, also aus dem Blutstrom, wird begleitet von einer zunehmenden Durchlässigkeit der Blut-Hirn-Schranke , was einerseits den Einstrom zellulärer Komponenten in das ZNS erleichtert und andererseits auch den Übertritt größerer Moleküle aus dem Blut in das ZNS-Gewebe hinein ermöglicht. Der Wirkmechanismus von Natalizumab beruht in der Blockade des Übertritts von CD4 +-T-Zellen (  Abb. 5.1: Natalizumab).
Abb. 5.1: Natalizumab).
Durch die Entzündung kommt es im ZNS zur Freisetzung von Antigenen im Bereich der Läsion, die aus dem ZNS hinaus passiv oder über phagozytotische Zellen aktiv in drainierende Lymphknoten transportiert werden. In den lymphatischen Organen kommt es hingegen zur Aktivierung von T-Zellen, die dann eine immungerichtete Antwort gegen diese Antigene initiieren oder perpetuieren (  Abb. 3.3).
Abb. 3.3).
Im Lymphknoten werden ebenfalls B-Zell-Antworten initiiert. Unklar bleibt gegenwärtig, ob die terminale Differenzierung von T- und B-Lymphozyten im Gehirn oder in lymphatischen Organen stattfindet (Uccelli et al. 2005).
3.2 Tiermodelle – die experimentelle autoimmune (allergische) Enzephalomyelitis
Viele Hypothesen zur Pathogenese und Therapie der MS entstammen Tiermodellen (Wekerle et al. 1994). Von besonderer Relevanz für die MS sind die Befunde bei der experimentellen autoimmunen Enzephalomyelitis (EAE) (Gold et al. 2006). Dabei existieren unterschiedliche Modelle. Durch die Immunisierung mit verschiedenen Myelin-Antigenen (z. B. basisches Myelinprotein, MBP; Proteolipid-Protein, PLP; Myelin Oligodendrozyten-Glykoprotein, MOG) zusammen mit Adjuvans (in der Regel abgetötetes mykobakterielles Extrakt vermischt mit Mineralöl [komplettes Freund’s Adjuvans] oder CpG DNS) kann in unterschiedlichen Tierspezies (Mäuse, Ratten, Meerschweinchen, Rhesusaffen, Marmosets) eine akut oder chronisch verlaufende (Enzephalo-)Myelitis induziert werden. Neben diesen Verfahren gibt es auch Verfahren mit passivem Transfer von T-Zellen, Mischformen und Versuche mit transgenen Tieren. Durch das Adjuvans kommt es zu einer starken phagozytischen Aktivität und Antigenpräsentation, die wiederum zu einer Aktivierung von CD4 +-T-Zellen führt. Die histopathologischen Veränderungen im ZNS der erkrankten Tiere ähneln in vielen Aspekten der MS. Das gilt vor allem für die mit dem Myelin-Bestandteil MOG in Makaken und Ratten aktiv induzierte EAE (Genain et al. 1995; Weissert et al. 1998). Neben einer Entzündung und Entmarkung weisen die Tiere auch einen Axonverlust auf (Kornek et al. 2000). Es findet sich eine kombinierte T-Zell- und antikörpervermittelte Pathogenese mit MS-typischen Läsionen, die sehr mit bestimmten pathologischen Charakteristika der MS übereinstimmt (Lucchinetti et al. 2000). Neben bestimmten mit MOG immunisierten Rattenstämmen (Storch et al. 1998) entwickeln auch Mäuse, die einen transgenen T-Zellrezeptor für MOG haben, eine Neuritis des Nervus opticus (Bettelli et al. 2006). Weiterhin wurde aus einer Kombination aus antigenspezifischen B- und T-Zellen eine Maus generiert, die viele Aspekte der Neuromyelitis optica reproduziert (Krishnamoorthy et al. 2006; Bettelli et al. 2006). Ein »spontanes« Modell spiegelt sogar den schubförmigen Verlauf der MS in SJL-Mäusen wider (Pöllinger et al. 2009).
Читать дальше

 Abb. 3.1). Eine Schädigung des ZNS-Gewebes induziert die Aktivierung residenter Immunzellen (Mikroglia und Astrozyten ) im ZNS, mit konsekutiver Aufregulation sog. MHC (Major Histocompatibility Complex)-Moleküle (beim Menschen auch HLA-Moleküle genannt), die für die Antigenpräsentation wichtig sind sowie zugehörige kostimulatorische Moleküle (
Abb. 3.1). Eine Schädigung des ZNS-Gewebes induziert die Aktivierung residenter Immunzellen (Mikroglia und Astrozyten ) im ZNS, mit konsekutiver Aufregulation sog. MHC (Major Histocompatibility Complex)-Moleküle (beim Menschen auch HLA-Moleküle genannt), die für die Antigenpräsentation wichtig sind sowie zugehörige kostimulatorische Moleküle ( 











