Bien, ya sabéis que algunos fermiones forman parte del átomo, pero ¿qué función desempeñan en este los bosones? Muy sencillo: los bosones son utilizados por las partículas de la materia para interaccionar entre ellas. Sin tratar de profundizar demasiado en este tema, podemos utilizar como ejemplo los electrones de la corteza y los protones del núcleo de un átomo. En este caso concreto, de las cuatro fuerzas, la que mantiene al electrón girando alrededor del núcleo es la electromagnética; y para ello el electrón situado en la corteza interacciona con los protones del núcleo del átomo «lanzándose» fotones. Podríamos imaginar este proceso como el juego que se establece entre dos amigos empeñados en pasar el tiempo lanzándose una pelota. En esta analogía, uno de los amigos desempeña el papel de electrón y el otro el de protón; obviamente, la pelota con la que interaccionan sería la partícula de fuerza del campo electromagnético: el fotón. De un modo similar, los quarks que constituyen los protones y neutrones de un átomo se mantienen unidos mediante la fuerza nuclear fuerte y, en este caso, son los gluones los que intervienen en la interacción.
Es posible que con tanto fermión y bosón hayáis terminado por despistaros ligeramente, de modo que voy a concretar. Resumiendo: la materia está formada por átomos, y estos a su vez están constituidos por dos tipos de fermiones: electrones y quarks, que interaccionan utilizando unas partículas de fuerza llamadas bosones (fotones, gluones…). A pesar de que conocemos muchos tipos de quarks, en el átomo solo encontraremos dos: los up y los down , que a través de la acción de los gluones se asocian de tres en tres para formar protones y neutrones. Los protones y los neutrones constituyen el núcleo de un átomo, el cual intercambia fotones con los electrones que giran a su alrededor (fig.1.3). Y esto, señores, es un átomo.
A través de los diferentes modelos habréis adquirido al menos una ligera idea de cómo es un átomo y, después de que lo hayamos destripado, también conocéis las distintas partículas que lo constituyen. Pues ha llegado el momento de hacernos una última e inquietante pregunta sobre ellos: ¿en qué lugar del universo se fabrican los átomos?
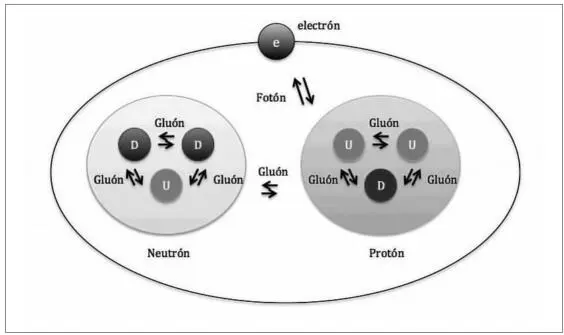
Fig. 1.3 Recreación de un átomo constituido por un protón, un neutrón y un electrón (podría tratarse del deuterio, un isótopo del átomo de hidrógeno).
Antes de responder a esta cuestión hay un aspecto que conviene aclarar, y es que cuando hablamos de átomos tenemos que tener en cuenta que existen muchos tipos de átomos diferentes; de hecho, vosotros mismos habréis visto por lo menos 115 representados en la tabla periódica. En realidad, a cada uno de los átomos que allí aparecen bien ordenaditos lo llamamos elemento químico, y lo más relevante es que cada uno de ellos viene determinado por el número de protones que contiene su núcleo. Así, el átomo con un único protón se llama hidrógeno (H), el que tiene dos se conoce como helio (He) y uno de los más pesados, con la friolera de 98 protones en su núcleo, lo hemos bautizado como uranio (U).
El que sepáis que existen muchos tipos distintos de átomos se me antoja relevante porque el origen de cada uno de ellos es diferente. Los átomos de hidrógeno y helio se formaron poco tiempo después del Big Bang; otros como el carbono (C), el oxígeno (O) o el nitrógeno (N) se originan en las estrellas mediante fusión nuclear; los átomos más pesados como la plata (Ag), el oro (Au) o el platino (Pt) solo surgen tras la explosión de una estrella masiva en forma de supernova; y elementos tan inestables como el americio (Am) o el curio (Cm) únicamente han podido ser fabricados por los humanos entre las cuatro paredes de un laboratorio.
EN BUSCA DE LA ESTABILIDAD
Hasta ahora he centrado vuestra atención sobre los átomos como elementos básicos de la materia, y si bien sin los átomos no seríamos absolutamente nada su sola presencia tampoco basta para que seamos algo. Los átomos de forma individual pueden formar nebulosas y estrellas, pero para crear un planeta, el agua o un árbol estas partículas deben unirse formando moléculas. Toda la materia que encontramos a nuestro alrededor, incluidos nosotros mismos, surge de la combinación de los átomos en forma de moléculas. La cuestión es ¿por qué se unen los átomos? Y la respuesta se puede resumir en una sola palabra: estabilidad. La mayoría de los átomos (todos a excepción de los gases nobles) interaccionan y se unen unos con otros en busca de la estabilidad. Todas las moléculas que encontramos en el universo son el resultado de la constante e interminable búsqueda de estabilidad en la que están inmersos los átomos.
Creo que he sido lo suficientemente pesadito como para dejaros muy claro que lo que buscan los átomos es… ¡estabilidad! Ya, pero os preguntaréis ¿qué diantres es la estabilidad para un átomo? Desde luego nada tiene que ver con sentar la cabeza, encontrar un trabajo fijo o una pareja, como me insistía mi madre; los átomos tienen «preocupaciones» de otra índole, a ellos lo que realmente les preocupa y ocupa son sus electrones.
Sabiendo que para un átomo los electrones son su «tesoro», creo que será una buena idea el que os presente a tres átomos de elementos químicos diferentes para que sean ellos mismos quienes os revelen sus inquietudes. La única manera que tienen los átomos para comunicarse con nosotros es a través de la configuración electrónica , que no es más que la ubicación de los electrones en la corteza.
A continuación podéis ver la configuración electrónica de los átomos de neón (Ne), sodio (Na) y cloro (Cl):
Ne 1s 22s 22p 6
Na 1s 22s 22p 63s 1
Cl 1s 22s 22p 63s 23p 5
Aunque algunos recordaréis de las clases del instituto cómo se interpreta una configuración electrónica, es posible que a otros os suene a arameo antiguo; de modo que voy a echaros una mano. El primer número que aparece en la configuración electrónica de un átomo hace referencia a la capa de la corteza donde se ubica el electrón. La letra que acompaña a la capa se refiere al orbital (el lugar dentro de la capa donde es más probable localizar el electrón). Mientras que el exponente que presenta el orbital nos indica el total de electrones que contiene.
Un aspecto relevante que quiero recordaros es que existen cuatro tipos de orbitales con diferente capacidad para contener electrones (figura 1.4); siendo el más pequeño el orbital s, en el que caben como máximo dos electrones, y el de mayor capacidad el orbital f, donde podemos meter hasta catorce electrones.
| Orbital |
Número de electrones |
| s |
2 |
| p |
6 |
| d |
10 |
| f |
14 |
Fig. 1.4 Orbitales atómicos con el número máximo de electrones que puede contener cada uno de ellos.
Con estas mínimas instrucciones podéis deducir fácilmente cómo se ubican los electrones en la corteza de, por ejemplo, el átomo de neón: sabemos que tiene dos capas (1 y 2) en su corteza, que en la capa 1 y dentro del orbital s hay dos electrones, y también que en la capa 2 posee dos orbitales (s y p) con un total de ocho electrones (2 + 6). Podéis hacer lo mismo con el Na y el Cl, y ya estaréis preparados para «escuchar» lo que os dicen estos átomos.
Y lo que dice la configuración electrónica del Ne es que, por el hecho de tener ocho electrones en la capa 2 (su última capa), se trata de un átomo estable. Tener en la última capa (lo que los químicos llamamos capa de valencia ) ocho electrones es precisamente lo que confiere estabilidad a un átomo. Conocidas cuáles son las necesidades de un átomo podéis daros cuenta de que ni el Na (al que le sobra un electrón) ni el Cl (al que le falta uno) son átomos estables.
Читать дальше













