Un modelo atómico es algo parecido: resulta que no podemos ver el átomo (es demasiado pequeño para poder observarlo incluso utilizando los microscopios más potentes), pero por suerte sí podemos conocer algunas de sus propiedades. Esas características sirven de guía a los científicos (como a ti las pistas que te he ido dando para dibujar el gamusino) para realizar un boceto del átomo. Pues precisamente la imagen que se va creando de un átomo en función de las pistas que tenemos es un modelo atómico.
El problema de Dalton radicaba en que disponía de muy pocas pistas sobre el átomo, de modo que su modelo es el más sencillo y, a la vez, el que más se aleja de la realidad. En su modelo atómico Dalton expone varias ideas, pero básicamente podemos recrearlo mediante una imagen muy sencilla que evoca mi niñez: una sólida e indestructible canica de acero. Para Dalton toda la materia estaba formada por átomos, y estos eran partículas tan indivisibles como lo fueran para Demócrito.
Unos años después, los científicos estaban experimentando con un juguetito de moda entre los físicos de aquella época (el tubo de rayos catódicos) cuando de repente surgió una nueva pista. Resulta que los átomos que formaban parte del gas encerrado dentro del tubo respondían ante un calambrazo liberando partículas con carga negativa. ¿De dónde habían salido esas partículas? Procedían de lo único que había dentro del tubo; ¡exactamente!, aquellas partículas no podían si no pertenecer a los átomos del gas allí encerrado. Tan inesperada pista rompía con la idea de que el átomo era una partícula indivisible: contenía, al menos, otros elementos más pequeños dotados de carga negativa que se llamaron electrones.
Esta revelación sirvió a J. J. Thomson para crear su propio modelo del átomo, que, como buen inglés, imaginó como un budín de pasas; pero yo sé que vosotros, golosones, más bien lo imaginaríais como una galletita Chips Ahoy . De este modo, con la boca hecha agua, el átomo de Thomson sería para nosotros una sólida galleta de enorme carga positiva, en cuya superficie aparecerían adheridos, a modo de pepitas de chocolate, los minúsculos electrones; tantos como para que la suma de sus pequeñas cargas negativas compensase la gran carga positiva de la galleta (figura 1.2).
Poco a poco el descubrimiento de las características del átomo se iba complicando, de tal manera que para obtener la siguiente pista fue necesario realizar un experimento más complejo que el de los rayos catódicos, que pasaría a la historia de la ciencia como el experimento de Rutherford .
Lo cierto es que puede que el ideólogo de dicho experimento fuera efectivamente Ernest Rutherford, pero las personas que se pasaron horas, días, semanas… lanzando monótonamente partículas alfa contra una lámina de oro fueron dos de sus estudiantes (¡ay!, ¿qué sería de la ciencia sin los becarios?). Las partículas alfa eran emitidas por un material radiactivo y estaban focalizadas sobre una finísima lámina de oro, alrededor de la cual se había situado una pantalla fluorescente que revelaba el destino final de los proyectiles y que, además, permitía reconstruir su trayectoria. Los investigadores observaron que la mayoría de las partículas que lanzaban contra la lámina de oro pasaban a través de ella sin desviarse. Una excelente pista para conocer cómo era el átomo, y que permitió a los científicos saber que este no se parece en nada a una sólida galleta, sino que, de hecho, se encuentra prácticamente vacío. Pero la pista más sorprendente tardó algún tiempo en manifestarse: tras muchos, muchísimos y aburridísimos lanzamientos se observó que algunas veces (muy, muy pocas) los proyectiles atravesaban la lámina de oro pero se desviaban ligeramente de su trayectoria original, y que, incluso, en alguna remota ocasión rebotaban sin atravesar la lámina contra la que eran lanzados (figura 1.1).
Ambas evidencias parecían indicar que en el interior del átomo, aun estando prácticamente vacío, existía una región sólida con carga positiva que se denominó núcleo. El núcleo del átomo debía ser minúsculo, pues la probabilidad de acertarle con una partícula era mínima. Y también debía poseer una carga positiva porque las partículas alfa que se lanzaban tenían precisamente una carga de tal naturaleza, de modo que solo desviarían su trayectoria al verse repelidas al pasar junto a un núcleo cargado positivamente.
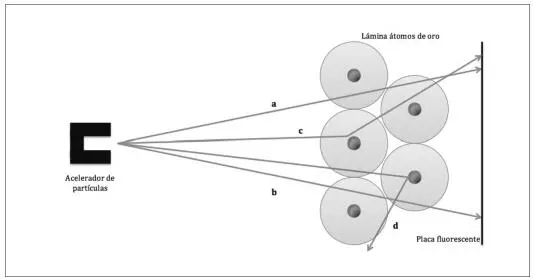
Fig. 1.1 Representación esquemática del experimento de Rutherford. Las flechas a y b indican partículas alfa que atraviesan la lámina de oro sin desviar su trayectoria (suceso mayoritario en el experimento). Las flechas c y d representan las trayectorias seguidas por las partículas alfa que pasan cerca del núcleo (y se ven ligeramente repelidas) y las que colisionan contra él, respectivamente.
Tras las observaciones de Rutherford, y con el descubrimiento de los protones y los neutrones, el nuevo modelo empezó a tomar forma; de hecho lo hizo imitando una configuración que nos era muy familiar: nuestro Sistema Solar. Del mismo modo que los planetas giran alrededor del Sol, en el átomo imaginado por Rutherford los electrones describen órbitas imaginarias alrededor del núcleo. Un núcleo en el que se apelotonan protones y neutrones, y tan pequeño que si pudiéramos hacer un zoom del átomo entero y ampliarlo hasta alcanzar las dimensiones del Estadio Santiago Bernabéu, tendría el tamaño de una pelota de ping-pong situada en el círculo central, y el resto (¡incluido el graderío!) estaría completamente vacío; solo, de vez en cuando, aparecería algún minúsculo electrón corriendo por las gradas.
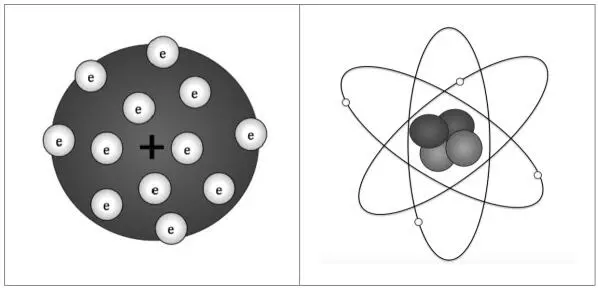
Fig. 1.2 Representación de los modelos atómicos de Thomson (izquierda) y de Rutherford (derecha).
El modelo de Rutherford es de una sencillez, y por tal motivo de una belleza, increíble; no en vano es la imagen que obtendremos si tecleamos «átomo» en Google, la que vemos en la secuencia de apertura de la serie The Big Bang Theory y la idea que se genera en vuestro cerebro cuando alguien, como yo hago ahora mismo, os habla del átomo. Sin embargo, a veces las cosas más hermosas no son compatibles con la realidad, y conste que cuando viajo a Nueva York todavía, ¡a mis cuarenta y tantos!, sigo mirando a lo alto esperando ver a Spider-Man saltando de un rascacielos a otro. De modo que lamento deciros que este modelo, pese a lo hermoso e intuitivo que resulta, fue rápidamente desechado debido, especialmente, a su inestabilidad.
Ya imagino que todos entenderéis que un individuo en mallas, que salta de edificio en edificio gracias a los superpoderes que ha adquirido por la picadura de una araña radiactiva, solo puede existir en las páginas de un cómic. Sin embargo, no creo que os queden tan claros los motivos que hacen que el átomo de Rutherford pertenezca al mismo mundo de ficción que mi superhéroe favorito. Así que, para dar respuesta a vuestras dudas, voy a hablaros de la inestabilidad que caracteriza al átomo según lo ideó Rutherford, y que lo hace incompatible con el mundo real. 1
La física que hasta entonces se conocía (llamada física clásica) nos venía a decir que el electrón, al desplazarse en su órbita, debería ir emitiendo parte de su energía. Y si esto sucediese, al electrón le tendría que pasar lo que a un avión que se queda sin combustible: iría cayendo poco a poco hacia el núcleo, y, dado el caso, el átomo sería cualquier cosa menos estable. Pero resulta que sabemos que esto en realidad no sucede, el átomo posee una estabilidad que no se corresponde en absoluto con el modelo propuesto por Rutherford.
Читать дальше














