Cheanyeh Cheng - Enzyme-Based Organic Synthesis
Здесь есть возможность читать онлайн «Cheanyeh Cheng - Enzyme-Based Organic Synthesis» — ознакомительный отрывок электронной книги совершенно бесплатно, а после прочтения отрывка купить полную версию. В некоторых случаях можно слушать аудио, скачать через торрент в формате fb2 и присутствует краткое содержание. Жанр: unrecognised, на английском языке. Описание произведения, (предисловие) а так же отзывы посетителей доступны на портале библиотеки ЛибКат.
- Название:Enzyme-Based Organic Synthesis
- Автор:
- Жанр:
- Год:неизвестен
- ISBN:нет данных
- Рейтинг книги:3 / 5. Голосов: 1
-
Избранное:Добавить в избранное
- Отзывы:
-
Ваша оценка:
- 60
- 1
- 2
- 3
- 4
- 5
Enzyme-Based Organic Synthesis: краткое содержание, описание и аннотация
Предлагаем к чтению аннотацию, описание, краткое содержание или предисловие (зависит от того, что написал сам автор книги «Enzyme-Based Organic Synthesis»). Если вы не нашли необходимую информацию о книге — напишите в комментариях, мы постараемся отыскать её.
An insightful exploration of an increasingly popular technique in organic chemistry Enzyme-Based Organic Synthesis
Enzyme-Based Organic Synthesis
Enzyme-Based Organic Synthesis
Enzyme-Based Organic Synthesis — читать онлайн ознакомительный отрывок
Ниже представлен текст книги, разбитый по страницам. Система сохранения места последней прочитанной страницы, позволяет с удобством читать онлайн бесплатно книгу «Enzyme-Based Organic Synthesis», без необходимости каждый раз заново искать на чём Вы остановились. Поставьте закладку, и сможете в любой момент перейти на страницу, на которой закончили чтение.
Интервал:
Закладка:
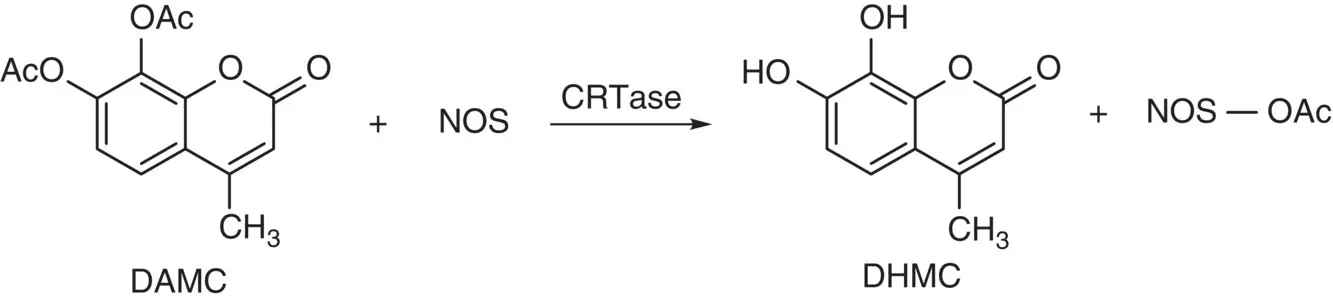
Scheme 3.15 Protein acetylation with CRTase and DAMC without involving acetyl‐CoA.
Source: Arora et al. [71].
The model acetoxy‐coumarins (AC), 7,8‐diacetoxy‐4‐methylcoumarin (DAMC), was shown to possess radical scavenger property by interacting with free radical to remove its acetyl group and give the acetyl cation (CH 3CO +) and the phenoxyl radical [68]. The antioxidant action of DAMC is independent on the formation of parent 7,8‐dihydroxy‐4‐methylcoumarin (DHMC). Calreticulin (CR) catalyzes the transfer of acetyl groups from AC to certain proteins [69, 70]; thus, CR was termed calreticulin transacetylase (CRTase). The enzymatic acetylation of protein by CRTase is unique and characterized as without involving acetyl‐CoA. CRTase of rat tracheal smooth muscle cells (TSMC) was characterized the specificity of DAMC for acetylating and activating nitric oxide synthase (NOS) as illustrated by Scheme 3.15[71]. Since the activated TSMC NOS will enhance NO in airway cells, and NO is believed to ameliorate the exacerbation of airway diseases such as asthma and coronary obstructive pulmonary diseases (COPD), AC may be expected to find therapeutic applications in respiratory diseases [71, 72].
References
1 1 Guo, F. and Berglund, P. (2017). Green Chem. 19: 333–360.
2 2 Fuchs, M., Farnberger, J.E., and Kroutil, W. (2015). Eur. J. Org. Chem. 6965–6962.
3 3 Truppo, M.D., Rozzell, J.D., Moore, J.C., and Turner, N.J. (2009). Org. Biomol. Chem. 7: 395–398.
4 4 Stewart, J.D. (2001). Current Opin. Chem. Biol. 5: 120–129.
5 5 Park, E., Kim, M., and Shin, J.‐S. (2010). Adv. Synth. Catal. 352: 3391–3398.
6 6 Land, H., Hendil‐Forssell, P., Martinelle, M., and Berglund, P. (2016). Catal. Sci. Technol. 6: 2897–2900.
7 7 Kohls, H., Anderson, M., Dickerhoff, J. et al. (2015). Adv. Synth. Catal. 357: 1808–1814.
8 8 Sattler, J.H., Fuchs, M., Mutti, F.G. et al. (2014). Angew. Chem., Int. Ed. 53: 14153–14157.
9 9 Mutti, F.G. and Kroutil, W. (2012). Adv. Synth. Catal. 354: 3409–3413.
10 10 Fuchs, C.S., Simon, R.C., Riethorst, W. et al. (2014). Biorg. Med. Chem. 22: 5558–5562.
11 11 Savile, C.K., Janey, J.M., Mundorff, E.C. et al. (2010). Science 329: 305–309.
12 12 Truppo, M.D., Strotman, H., and Hughes, G. (2012). ChemCatChem 4: 1071–1074.
13 13 Andrade, L.H., Kroutil, W., and Jamison, T.F. (2014). Org. Lett. 16: 6092–6095.
14 14 Wohlgemuth, R. (2005). Chimia 59: 735–740.
15 15 Křen, V. and Thiem, J. (1997). Chem. Chem. Soc. Rev. 26: 463–473.
16 16 Gloster, T.M. (2014). Curr. Opin. Chem. Biol. 28: 131–141.
17 17 Leloir, L.F. (1971). Science 172: 1299–1303.
18 18 Koeller, K.M. and Wong, C.‐H. (2000). Chem. Rev. 100: 4465–4493.
19 19 Tsuji, S. (1996). J. Biochem. 120: 1–13.
20 20 Sears, P. and Wong, C.‐H. (1998). Cell. Mol. Life Sci. 54: 223–252.
21 21 Wong, C.‐H., Haynie, S.L., and Whitesides, G.M. (1982). J Org. Chem. 47: 5416–5418.
22 22 Křen, V. (1997). Top. Curr. Chem. 186: 45–64.
23 23 Riva, S.J. (2002). Mol. Catal. B Enzym. 19‐20: 43–54.
24 24 Kaulpiboon, J., Pongsawasdi, P., and Zimmermann, W. (2007). FEBS J. 274: 1001–1010.
25 25 Van der Veen, B.A., van Alebeek, G.‐J.W.M., Uitdehaag, J.C.M. et al. (2000). Eur. J. Biochem. 267: 658–665.
26 26 Pitcher, J., Smythe, C., and Cohen, P. (1988). Eur. J. Biochem. 176: 391–395.
27 27 Hurley, T.D., Stout, S., Miner, E. et al. (2005). J. Biol. Chem. 280: 23892–23899.
28 28 Smythe, C. and Cohen, P. (1991). Eur. J. Biochem. 200: 625–631.
29 29 Zeqiraj, E., Tang, X., Hunter, R.W. et al. (2014). Proc. Natl. Acad. Sci. USA 111: E2831–E2840.
30 30 Zhang, Z., Gildersleeve, J., Yang, Y.‐Y. et al. (2004). Science 303: 371–373.
31 31 Wong, C.‐H. (2005). J. Org. Chem. 70: 4219–4225.
32 32 Rush, R.S., Derby, P.L., Smith, D.M. et al. (1995). Anal. Chem. 67: 1442–1452.
33 33 Sears, P. and Wong, C.‐H. (2001). Science 291: 2344–2350.
34 34 Macmillan, D. and Bertozzi, C.R.A. (2004). Chem. Int, Ed. 43: 1355–1359.
35 35 Wang, L. and Schult, P.G. (2005). Angew. Chem. Int. Ed. 44: 34–66.
36 36 Liu, H., Wang, L., Brock, A. et al. (2003). J. Am. Chem. Soc. 125: 1702–1703.
37 37 Xu, R., Hanson, S.R., Zhang, Z. et al. (2004). J. Am. Chem. Soc. 126: 15654–15655.
38 38 McMurry, J.; Castellion, M.E. (1999). Fundamentals of General, Organic, and Biological Chemistry, 3rd Ed., Prentice Hall, New Jersey: Upper Saddle River, pp. 673.
39 39 Uliana, A.S., Crespo, P.M., Martina, J.A. et al. (2006). J. Biol. Chem. 281: 32852–32860.
40 40 Giraudo, C.G. and Maccioni, H.J.F. (2003). J. Biol. Chem. 278: 40262–40271.
41 41 Chapman, E. and Wong, C.‐H. (2002). Bioorg. Med. Chem. 10: 551–555.
42 42 Renzone, G., Salzano, A.M., Arena, S.D. et al. (2006). J. Proteome Res. 5: 2019–2024.
43 43 Jin, Y., Molt, R.W. Jr., and Blackburn, G.M. (2017). Top. Curr. Chem.(Z) 375: 36–66.
44 44 Thiaville, J.J., Flood, J., Yurgrl, S. et al. (2016). ACS Chem. Biol. 11: 2304–2311.
45 45 Sfeir, C., Fang, P.‐A., Jayaraman, T. et al. (2014). Acta Biomater. 10: 2241–2249.
46 46 Rivière, L., Moreau, P., Allmann, S. et al. (2009). PNAS 106: 12694–12699.
47 47 Kuang, Y., Salem, N., Wang, F. et al. (2007). J. Biochem. Biophys. Methods 70: 649–655.
48 48 Tan, D.‐X., Hardeland, R., Back, K. et al. (2016). J. Pineal Res. 61: 27–40.
49 49 Weissbach, H., Redfield, B.G., and Axelrod, J. (1960). Biochim. Biophys. Acta 43: 352–353.
50 50 Axelrod, J. and Weissbach, H. (1960). Science 131: 1312.
51 51 Liu, J., Ng, T., Rui, Z. et al. (2014). Angew. Chem. Int. Ed. 53: 136–139.
52 52 Witkop, B. (1998). Heterocycles 49: 9–27.
53 53 Granacher, R.P. and Baldessarini, R.J. (1976). Clin. Neuropharmacol. 1: 63–79.
54 54 Brockhausen, I., Nair, D.G., Chen, M. et al. (2016). Biochem. Cell Biol. 94: 197–204.
55 55 Vetting, M.W., de Carvalho, L.P.S., Yu, M. et al. (2005). Arch. Biochem. Biophys. 433: 212–226.
56 56 Wang, S.X., Cherian, A., Dumitriu, M. et al. (2007). J. Rheumatol. 34: 712–720.
57 57 Brockhausen, I. and Anastassiades, T.P. (2008). Expert Rev. Clin. Immunol. 4: 173–191.
58 58 Anastssiades, T., Rees‐Milton, K., Xiao, H. et al. (2013). Transl. Res. 162: 93–101.
59 59 Walsh, C.T., Garneau‐Tsodikova, S., and Gatto, G.J. Jr. (2005). Angew. Chem. Int. Ed. Engl. 44: 7342–7372.
60 60 Clark, R.S., Bayir, H., and Jenkins, L.W. (2005). Crit. Care Med. 33: S407–S409.
61 61 Kim, Y., Tanner, K.G., and Denu, J.M. (2000). Anal. Biochem. 280: 380–314.
62 62 Grunstein, M. (1997). Nature 389: 349–352.
63 63 Guarente, L. and Picard, F. (2005). Cell 120: 473–482.
64 64 Timmermann, S., Lehrmann, H., Polesskaya, A., and Harel‐Bellan, A. (2001). Cell Mol. Life Sci. 58: 728–736.
65 65 Jaudzems, K., Kuka, J., Gutsaits, A. et al. (2009). Enzym. Inhib. Med. Chem. 24: 1269–1275.
66 66 Longo, N., Frigeni, M., and Pasquali, M. (1863). Biochim. Biophys. Acta 2016 : 2422–1325.
67 67 Ramsay, R.R. and Zammit, V.A. (2004). Mol. Aspects Med. 25: 475–493.
68 68 Raj, H.G., Parmer, V.S., Jain, S.C. et al. (1999). Bioorg. Med. Chem. 7: 2091–2094.
69 69 Raj, H.G., Parmer, V.S., Jain, S.C. et al. (1999). Bioorg. Med. Chem. 7: 369–373.
70 70 Raj, H.G., Parmer, V.S., Jain, S.C. et al. (2000). Bioorg. Med. Chem. 8: 1707–1712.
71 71 Arora, S., Vohra, P., Kumar, A. et al. (2008). Biol. Pharm. Bull. 31: 709–713.
Читать дальшеИнтервал:
Закладка:
Похожие книги на «Enzyme-Based Organic Synthesis»
Представляем Вашему вниманию похожие книги на «Enzyme-Based Organic Synthesis» списком для выбора. Мы отобрали схожую по названию и смыслу литературу в надежде предоставить читателям больше вариантов отыскать новые, интересные, ещё непрочитанные произведения.
Обсуждение, отзывы о книге «Enzyme-Based Organic Synthesis» и просто собственные мнения читателей. Оставьте ваши комментарии, напишите, что Вы думаете о произведении, его смысле или главных героях. Укажите что конкретно понравилось, а что нет, и почему Вы так считаете.












