Nachdem man sich für den Modus der 2D-Trennung entschieden hat, besteht die nächste wichtige Entscheidung darin, welche zwei Trennmodi in der ersten und zweiten Dimension des 2D-Systems verwendet werden.
1.3.1 Komplementarität als Leitmotiv
In der Literatur über 2D-Trennungen wird viel über das Prinzip der „Orthogonalität“ diskutiert, in Bezug auf die Auswahl der Trennmodi, die in einer 2D-Trennung verwendet werden sollten. Der Grund für die Forderung nach Orthogonalität ist, dass es von einem rein theoretischen Standpunkt aus gesehen am besten ist, wenn die aus den 1D- und 2D-Trennungen erhaltenen Retentionsmuster nicht korrelieren [17]. Ich denke jedoch, dass es von größerer praktischer Relevanz ist, über die Komplementarität der beiden in der 2D-Trennung verwendeten Trennmodi nachzudenken. Inwieweit ergänzt der in der zweiten Dimension verwendete Trennmodus die bereits in der ersten Dimension verwendete Trennung? Ein konkretes Beispiel soll helfen, diesen Punkt zu verdeutlichen. Nehmen wir an, wir trennen eine Mischung von Peptiden, die sowohl in der Gesamtzahl der Aminosäurereste als auch in der Anzahl der Lysinreste variieren, sodass deren positive Ladung in Lösung ebenfalls variiert (bei niedrigem pH-Wert). Wenn wir ein 2D-LC-System aus RP-C18-Säulen und mobilen Phasen mit niedrigem pH-Wert in beiden Dimensionen vorsehen würden, wird dies keine effektive 2D-Trennung ergeben, da die zweite Trennung keine neue Trennselektivität hinzufügt. Nehmen wir nun an, wir ändern die 1D-Trennung in Kationenaustausch (CEX), wo die Peptide hauptsächlich nach ihrem Grad der positiven Ladung eluieren werden (niedrige Ladung eluiert zuerst, hohe Ladung eluiert zuletzt). Wenn wir nun eine 2D-Trennung mit einer RP C18-Säule hinzufügen, wird diese die 1D-Trennung gut ergänzen, da sie sich hauptsächlich nach der Wasserlöslichkeit der Peptide trennt (die am besten löslichen eluieren zuerst, die am wenigsten löslichen zuletzt). In diesem Fall können wir zwei Peptide haben, die die gleiche Ladung tragen – und somit in der CEX-Trennung koeluieren – aber aufgrund von Unterschieden in der Anzahl und/oder der Art der Aminosäuren sehr unterschiedliche Wasserlöslichkeiten (und somit unterschiedliche Hydrophobizität) haben, die sich durch die 2D-RP-Säule leicht trennen lassen.
In der Vergangenheit wurde viel Mühe darauf verwendet, herauszufinden, welche Trennmodi für verschiedene Probentypen und Anwendungen am besten geeignet sind. Heutige Anwender können diese Ergebnisse als Grundlage für ihre eigene Arbeit verwenden. Für einige Anwendungsbereiche gibt es gute Veröffentlichungen, die die Komplementarität verschiedener Trennungen für bestimmte Molekültypen wie z. B. Peptide veranschaulichen [18]. Ich empfehle den Lesern, auch 2D-LC-Datenbanken zu konsultieren, um die jeweils besten Trennungen für ihre Anwendung herauszufinden. 1)
1.3.2 Die Pirok-Kompatibilitätstabelle
Leider müssen wir mehr als nur die Komplementarität der Selektivitäten der unterschiedlichen Trennmodi berücksichtigen, die bei einer 2D-LC-Trennung verwendet werden. Andere Faktoren wie die Kompatibilität der mobilen Phasen mit den einzelnen Trennmodi sind ebenso wichtig und können die Kombination von Trennmodi, die unter dem Gesichtspunkt der Selektivität recht attraktiv aussieht, in der Praxis unbrauchbar machen. Zum Beispiel ist die Kombination einer Normalphasen-(NP)- Trennung (d. h. nicht modifiziertes Kieselgel als stationäre Phase, Hexan als mobile Phase) mit einer RP-Trennung für einige Anwendungen attraktiv, weil die NP- Trennung von adsorptiven Wechselwirkungen zwischen Analyt und stationärer Phase dominiert wird, während die RP-Trennung von der Verteilung der Analyten in eine gebundene stationäre Phase dominiert wird. Dieser Unterschied in den Retentionsmechanismen kann zu hochgradig komplementären Selektivitäten führen. Allerdings stoßen wir in diesem Fall auf eine größere praktische Schwierigkeit, da die unpolaren mobilen Phasen mit einem hohen Anteil organischer Lösungsmittel, die für NP-Trennungen verwendet werden, mit den wasserreichen mobilen Phasen, die für RP-Trennungen verwendet werden, nicht mischbar sind – zumindest nicht über einen breiten Mischungsbereich. Dieser Umstand schränkt die Verwendung einiger Kombinationen von Trennmodi wie NP-RP ein, obwohl selbst in diesem Fall das Mischbarkeitsproblem durch die Injektion sehr kleiner Mengen von 1D-Eluat in große 2D-Säulen beherrscht werden kann [19]. Pirok und Schoenmakers haben die Kenntnisse über die Kompatibilität diverser Trennungen in der 2D-LC gesammelt und in der in Abb. 1.3 dargestellten Tabelle zusammengefasst. Grau schattierte Kombinationen sollten gut funktionieren, während hellgrau schattierte Kombinationen mindestens ein oder mehrere Probleme erzeugen, die gelöst werden müssen, bevor sie für eine 2D-Trennung ausgewählt werden. Leser, die an einer detaillierteren Erklärung aller Informationen in dieser Tabelle interessiert sind, werden auf die Originalarbeit von Pirok und Schoenmakers verwiesen [20]. Die Tabelle wird im Zuge der Weiterentwicklung der 2D-LC-Technologie ständig aktualisiert; eine aktuelle Version ist auf unserer Website 2) zu finden.

Abb. 1.3Matrix zur Kompatibilität der verschiedenen Trennungsmodi bei der Verwendung in der ersten oder zweiten Dimension von 2D-LC-Systemen. Abdruck mit Genehmigung aus [20].
1.3.3 Bestimmung der Komplementarität von Trennungen
Sobald wir eine erste Auswahl der beiden Trennmodi für unsere 2D-LC-Trennung getroffen haben, müssen wir die Qualität der resultierenden Trennung beurteilen. Für spezifischere Trennungen sind wir normalerweise am meisten daran interessiert, eine oder mehrere Zielsubstanzen untereinander oder von der Probenmatrix aufzulösen. In diesem Fall reicht es aus, zu beurteilen, inwieweit die 2D-Trennung die Substanzen getrennt hat, die von der 1D-Säule koeluieren; dies ist ein Maß für die Komplementarität der beiden Trennungen. Bei umfassenderen Trennungen interessiert uns in der Regel, inwieweit durch das Zusammenspiel von 1D- und 2D-Trennung die Bestandteile der Probe über den gesamten Trennbereich verteilt sind. Die Notwendigkeit, dies zu beurteilen, hat viele Gruppen dazu veranlasst, eigene Metriken zu entwickeln, die in neueren Artikeln kritisch diskutiert und verglichen wurden [21, 22]. In unserer eigenen Arbeit haben wir den in Abb. 1.4 dargestellten Ansatz verwendet, der darauf hinausläuft, den Anteil des verfügbaren 2D-Trennbereichs, der die Peaks enthält, zu schätzen, indem die Anzahl der Segmente, die Peaks enthalten, ermittelt und durch die Gesamtzahl der Segmente des Trennbereichs geteilt wird. Während der Methodenentwicklung passen wir die Elutionsbedingungen in beiden Dimensionen an, um die Peaks so breit wie möglich über den Trennbereich zu verteilen und so eine möglichst 100-prozentige Abdeckung des Raumes zu erreichen. Dies ist in der Praxis nur selten möglich, aber einige Anwendungen können mehr als 90 % Abdeckung erreichen [23].
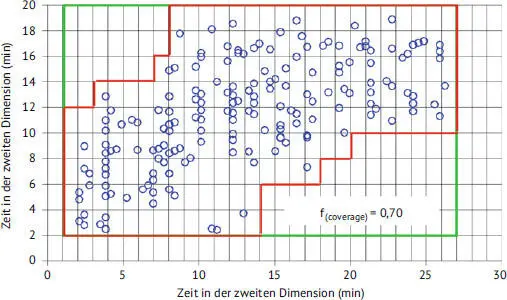
Abb. 1.4Darstellung des häufig verwendeten Ansatzes zur Schätzung des Anteils des 2D-Trennraums, der bei der Analyse realer Proben von Peaks belegt wird. Die graue Umrandung erfasst die Bereiche, in denen Peaks normalerweise auftreten können. Außerhalb der Umrandung liegen die Totzeiten und Äquilibrierungszeiten der ersten und zweiten Dimension. Nach [24].
Читать дальше














