Гибридные атомные орбитали: треугольные молекулы
Как отмечалось при обсуждении рис. 14.3, молекула BH 3треугольная с углами 120° между связями. Атом бора имеет три валентных электрона: два на 2 s -орбитали и один на 2 p -орбитали. Для образования трёх электронных пар, совместно используемых с тремя атомами водорода, атому бора требуется три неспаренных электрона. В верхней части рис. 14.7 показано, что атом B поднимает один электрон с 2 s -орбитали на 2 p -орбиталь, чтобы получить три неспаренных электрона. Если молекула лежит в плоскости xy , то задействованными в образовании связей 2 p -орбиталями будут 2 p xи 2 p y. Для того чтобы молекула BH 3имела форму равностороннего треугольника, три атомные орбитали бора гибридизируются и дают три гибридные атомные орбитали: sp a 2, sp b 2и sp c 2. Обозначение sp 2указывает на то, что гибридные орбитали состоят из одной s -орбитали и двух разных p -орбиталей. Мы начинаем с трёх разных орбиталей: 2 s , 2 p xи 2 p y. Орбитали никогда не возникают и не пропадают, поэтому получаются три различные гибридные орбитали. Они показаны в средней части рис. 14.7. Каждая орбиталь имеет положительный и отрицательный лепестки. Соседние лепестки расположены под углом 120° по отношению друг к другу. Каждая из орбиталей содержит по одному из трёх неспаренных валентных электронов атома бора.
В нижней части рис. 14.7 показано связывание атома B с тремя атомами H. Каждый атом H имеет единственный 1 s -электрон. 1 s -орбиталь атома H объединяется с sp 2-орбиталью атома B и образует связывающую молекулярную орбиталь. В результате появляются связывающие пары электронов. Каждая из этих связей между атомами B и H является σ-связью, поскольку имеется ненулевая электронная плотность на прямой, соединяющей ядра. Модель молекулы BH 3представлена на рис. 14.3.
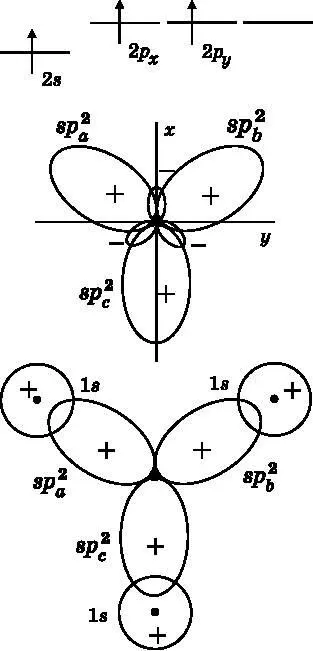
Рис. 14.7. Вверху: валентные электроны бора, один из которых поднят на 2p — орбиталь. Посередине: 2s-, 2p x - и 2p y -орбитали бора объединяются тремя способами и образуют три гибридные атомные орбитали: sp a 2, sp b 2 и sp c 2 . Угол между лепестками составляет 120°. Внизу: три гибридные орбитали атома бора образуют связи с 1s-орбиталями трёх атомов H
Гибридные атомные орбитали: тетраэдрические молекулы
В молекуле метана углерод создаёт четыре связи с четырьмя атомами водорода. Как говорилось выше и показано на рис. 14.1 и 14.2, молекула метана имеет форму тетраэдра. На рис. 14.4 видно, что для создания четырёх валентных связей, совместно использующих электронные пары, углерод поднимает один из своих 2 s -электронов на 2 p -орбиталь. В результате у него появляется четыре неспаренных электрона на 2 s -, 2 p x-, 2 p y- и 2 p z-орбиталях. При обсуждении рис. 14.4 уже довольно подробно объяснялось, что эти четыре атомные орбитали не могут породить одинаковые связи с четырьмя атомами водорода и привести к появлению тетраэдрической молекулы. Поэтому 2 s -, 2 p x-, 2 p y- и 2 p z-орбитали объединяются в четырёх различных комбинациях и образуют четыре гибридные атомные орбитали: sp a 3, sp b 3, sp c 3и sp d 3. Обозначение sp 3указывает на то, что каждая из четырёх гибридных атомных орбиталей является комбинацией s -орбитали и трёх различных p -орбиталей.
На рис. 14.8 показано, что четыре sp 3-орбитали перекрываются с четырьмя 1 s -орбиталями атомов водорода. Изображены только положительные лепестки sp 3-орбиталей. Каждая из них имеет небольшой отрицательный лепесток, направленный в сторону, противоположную положительному лепестку, аналогично тому, как это показано на среднем изображении рис. 14.7 для sp 2-орбиталей. Орбитали, изображённые штриховыми кривыми, лежат в плоскости страницы. Орбиталь, показанная сплошной кривой, выступает под углом над плоскостью страницы, а орбиталь, показанная штрихпунктирной линией, уходит под углом за плоскость страницы. Угол между любой парой sp 3-лепестков составляет 109,5°, что обеспечивает правильную тетраэдрическую форму, о которой говорилось при обсуждении рис. 14.1 и 14.2.
На рис. 14.2 изображены молекулы метана, аммиака и воды. Как уже говорилось, все они имеют тетраэдрическую форму, если включить в рассмотрение неподелённые пары, но молекулы аммиака и воды имеют форму не совсем правильных тетраэдров. Подобно метану, аммиак и вода также используют sp 3-гибридизацию для образования связей. Азот в аммиаке NH 3имеет пять валентных электронов. Два из них образуют неподелённую пару. Она не участвует в образовании химических связей. Азот использует три из своих четырёх гибридных sp 3-орбиталей для соединения с тремя атомами H. Четвёртая sp 3-орбиталь содержит неподелённую пару.
Читать дальше













