Однако нет никаких причин, по которым все атомы должны лежать в одной плоскости. В структуре, изображённой на рис. 14.1 слева, угол между верхним и нижним атомами H равен 180°, и эти две C−H-связи находятся далеко друг от друга; то же самое верно и для атомов H, находящихся слева и справа. Представьте теперь, что верхний и нижний атомы H выталкиваются выше плоскости страницы, а правый и левый атомы H — ниже плоскости страницы при сохранении длины связей. Верхняя и нижняя C−H-связи сближаются друг с другом, и угол между ними становится меньше 180°, но они удаляются от правой и левой C−H-связей. Подъём верхней и нижней C−H-связей над плоскостью страницы и опускание левой и правой C−H-связей ниже, под эту плоскость, уменьшают совокупное взаимодействие между связями. Взаимодействие между верхней и нижней связями усиливается, но исходно они были очень далеки друг от друга. Это также верно для левой и правой связей. Однако если углы между верхней и нижней или левой и правой связями уменьшатся слишком сильно, отталкивание снова начнёт увеличиваться. Имеется наилучший угол, и он составляет 109,5°, что соответствует правильному тетраэдру. При таком угле электроны C−H-связей удерживаются так далеко друг от друга, насколько это возможно.
Неподелённые пары тоже имеют значение
В главе 11 мы узнали, что для получения замкнутой электронной конфигурации атом C нуждается в образовании четырёх связей, для атома N требуется три связи, а для атома O — две связи. Если это будут связи с водородом, то получится метан, аммиак и вода: CH 4, NH 3и H 2O. При обсуждении молекулы HF в конце главы 13 мы отметили, что некоторые электроны атома F совершенно не были вовлечены в образование связей. Эти электроны находятся в спаренном состоянии, по сути, на атомных орбиталях, и называются неподелёнными парами. Неподелённые пары — это пары несвязывающих электронов, которые вызывают повышение электронной плотности в той области пространства, которую они занимают. Электроны, образующие связи, избегают располагаться вблизи неподелённых пар. Поэтому хотя неподелённые пары не являются связями, они также влияют на форму молекул. В связях электроны используются совместно и в основном концентрируются где-то между двумя атомами. Неподелённые пары не тянутся ко второму атому. Как следствие, их электронные облака расположены вблизи атомов, которым они принадлежат, и по размерам они больше, чем облака пар, образующих связи.
На рис. 14.2 изображены модели молекул метана, аммиака и воды. У аммиака имеется одна неподелённая пара, а у воды — две. Если принять в расчёт неподелённые пары, то все три молекулы имеют в своей основе тетраэдрическую форму. Однако аммиак и вода представляют собой неправильные тетраэдры. Неподелённая пара аммиака больше по размеру, чем связывающие пары. Чтобы минимизировать общее электрон-электронное отталкивание и достичь наименьшей энергии, связи удаляются от неподелённых пар, а значит, сближаются между собой. Угол HNH в молекуле аммиака составляет 107,3° — чуть меньше, чем в правильном тетраэдре. У воды две неподелённые пары, и поэтому угол между водород-кислородными связями уменьшается ещё сильнее — до 104,5°.
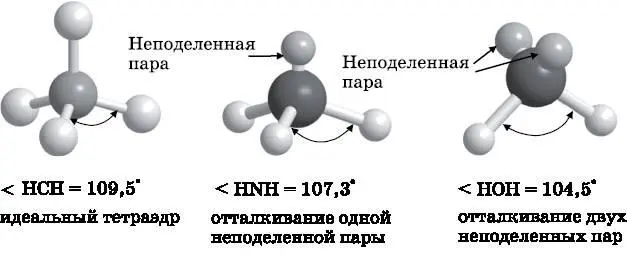
Рис. 14.2. Метан (слева), аммиак (посередине) и вода (справа). Неподелённые пары электронов отталкивают связывающие пары электронов, заставляя связи сближаться, из-за чего уменьшаются углы между связями атомов H с центральным атомом
Молекулы треугольной формы
Если центральный атом связан только с тремя другими атомами, молекула будет иметь прямоугольную форму с четырьмя атомами, лежащими в одной плоскости. На рис. 14.3 изображены две треугольные молекулы: BH 3и H 2CO (формальдегид). Молекула BH 3существует, но она химически очень активна, поскольку ей не хватает двух электронов до замкнутой конфигурации оболочки, как у неона. В BH 3каждый атом H имеет одиночную связь с B. Угол HBH равен в точности 120°. Атомы водорода образуют идеальный равносторонний треугольник. При такой форме молекулы связи оказываются максимально удалёнными друг от друга, что снижает энергию за счёт уменьшения отталкивания между связывающими электронами каждой связи.
В главе 13 на диаграмме МО для O 2(см. рис. 13.8) показано, что молекула кислорода имеет двойную связь. В формальдегиде (пахучей жидкости, которой заполняют банки с биологическими образцами в кабинетах биологии) атом O имеет двойную связь с атомом C. Эта двойная связь показана на шаростержневой модели двумя цилиндрами, соединяющими атомы, вместо одного. Двойная связь обеспечивает атому O замкнутую неоновую конфигурацию оболочки, как в молекуле О 2. Атом C нуждается в двух дополнительных электронах, чтобы получить замкнутую неоновую конфигурацию оболочки, и он получает их за счёт одиночных связей с двумя атомами H. Мы ещё обсудим подробно двойные связи, чтобы разобраться, как они могут образовываться из атомных орбиталей, но сейчас нам нужно лишь понять, что двойная связь концентрирует две пары электронов между атомами C и O. Из-за этой дополнительной электронной плотности двойная связь становится шире одиночной. Более толстая двойная связь C=O расталкивает одиночные связи C−H, заставляя их сближаться друг с другом. Все углы обозначены на рис. 14.3. В результате молекула формальдегида, оставаясь плоской треугольной, отклоняется от формы равностороннего треугольника.
Читать дальше













