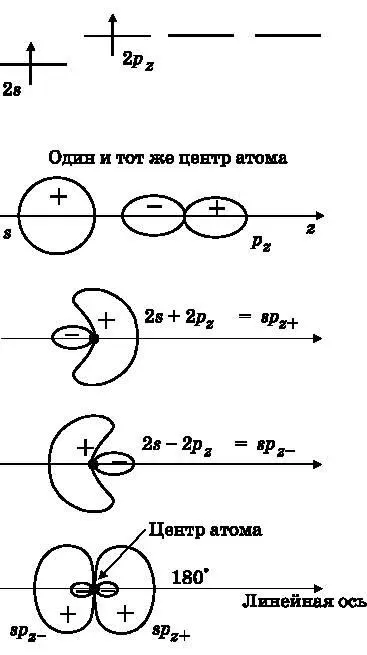
Рис. 14.5. Вверху: валентные электроны Be, один из которых перешёл на 2p z -орбиталь. Ниже: 2s- и 2p z -орбитали Be, показанные по отдельности. Ниже: сумма 2s- и 2p z -орбиталей даёт гибридную атомную орбиталь sp z + . Ниже: разность 2s и 2p z -орбиталей даёт гибридную орбиталь sp z− . Внизу: две гибридные орбитали бериллия направлены в противоположные стороны вдоль оси z
Ниже на этом рисунке 2 s- и 2 p z-орбитали схематически показаны по отдельности. В действительности они имеют общий центр, совпадающий с ядром Be. Эти орбитали являются волнами амплитуды вероятности электрона. Волны могут складываться и вычитаться, порождая новые волны. Начнём с двух атомных орбиталей — 2 s и 2 p z; далее путём сложения и вычитания получим две новые атомные орбитали, называемые гибридными орбиталями. Когда волны складываются, получаются области конструктивной и деструктивной интерференции, поскольку лепестки волн амплитуды вероятности имеют знак. На третьем сверху изображении на рис. 14.5 показана сумма 2 s - и 2 p z-орбиталей. Она называется sp -гибридизированной орбиталью и обозначается sp z+, поскольку является гибридом, полученным из s -орбитали и 2 p z-орбитали, а её большой положительный лепесток направлен в положительную сторону оси z .
На втором снизу изображении на рис. 14.5 показана разность 2 s - и 2 p z-орбиталей. Один из способов представить себе это состоит в том, чтобы просто отразить 2 p z-орбиталь с верхнего изображения, так чтобы её положительный лепесток смотрел влево, а не вправо, и после этого выполнить сложение. Мы обозначили эту гибридную орбиталь sp z−, поскольку её большой положительный лепесток направлен в отрицательную сторону оси z . Эта орбиталь имеет такую же форму, как sp z+, но ориентирована в противоположную сторону. На нижнем рисунке схематически изображены гибридные атомные орбитали в том виде, в каком они присутствуют в атоме Be. Имеется одно ядро бериллия с двумя гибридными орбиталями, ориентированными по направлениям + z и − z соответственно.
Образуя молекулу BeH 2, бериллий будет использовать две гибридные атомные орбитали для формирования электронных пар на молекулярных орбиталях, связывающих его с двумя атомами водорода. Эти связи схематически изображены на рис. 14.6. В верхней части рисунка показаны два атома водорода: H a и H b , приближающиеся к атому Be. Электроны атомов водорода находятся на 1s-орбиталях 1 s a и 1 s b . У бериллия имеются две гибридные атомные орбитали: sp z−и sp z+, направленные в сторону 1 s -орбиталей водорода. В средней части рисунка схематически показано перекрытие атомных орбиталей. Водородная 1 s a -орбиталь слева образует связывающую МО с гибридной атомной орбиталью sp z−бериллия. Это связывающая МО будет содержать два электрона: один от водорода и один из двух валентных электронов бериллия. Водородная 1 s b -орбиталь справа образует связывающую МО с гибридной атомной орбиталью sp z+. Электрон атома H b и другой валентный электрон атома Be образуют ещё одну ковалентную связь. Это будут σ-связи, поскольку электронная плотность вдоль линии, соединяющей ядра, отлична от нуля. В результате получается линейная молекула BeH 2, изображённая в нижней части рисунка.
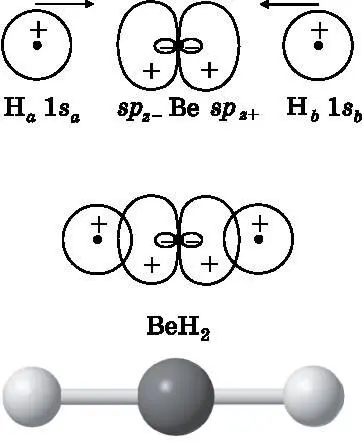
Рис. 14.6. Вверху: два атома H приближаются к атому Be. В середине: 1s-орбитали атома H образуют парные электронные связи с двумя sp-гибридизированными орбиталями атома Be, в результате чего формируется линейная молекула BeH 2 , изображённая внизу в виде шаростержневой модели
Молекула BeH 2имеет шесть электронов: две пары связывающих электронов и два электрона на 1 s -орбитали атома Be. Важно отметить, что все эти электроны являются волнами амплитуды вероятности, которые охватывают всю молекулу. Когда говорится, что 1 s a -электрон создаёт связывающую электронную пару с sp z−-электроном, — это «бухгалтерская» условность. Все электроны свободно перемещаются по целой молекуле. Однако распределения вероятности для электронов таковы, что в любой данный момент электронная плотность, связанная с атомом Be и одним из атомов H, соответствует одной связи, а электронная плотность, связанная с атомом Be и другим атомом H, соответствует другой связи.
Читать дальше














