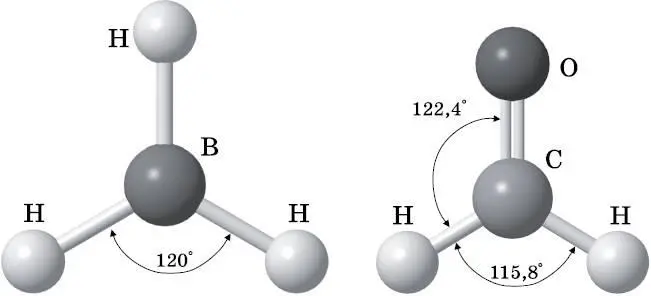
Рис. 14.3. Слева: молекула BH 3 . Атомы лежат в одной плоскости. Связи HB являются одинарными, атомы водорода образуют равносторонний треугольник. Все углы HBH равны 120°. Справа: молекула H 2 CO (формальдегид). Атомы лежат в одной плоскости. Связь CO — двойная. Углы не равны
Возвращаясь к метану, зададимся вопросом: каким образом он формирует четыре связи в тетраэдрической конфигурации? В главе 11 обсуждались электронные конфигурации атомов (см. рис. 11.1). Углерод имеет шесть электронов: два на 1 s -орбитали, два на 2 s -орбитали и два на 2 p -орбитали. Валентные электроны, то есть участвующие в образовании химических связей, — это 2 s - и 2 p -электроны. В верхней части рис. 14.4 показаны энергетические уровни атомных орбиталей с заполняющими их четырьмя валентными электронами. 1 s -электроны не показаны.
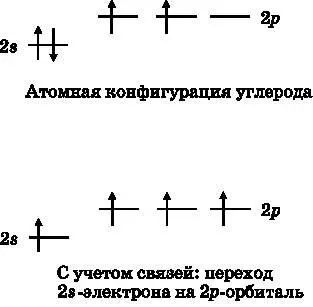
Рис. 14.4. Вверху: атомные валентные орбитали электрона с четырьмя валентными электронами. Внизу: при образовании химических связей атом углерода «повышает» 2s-электрон до уровня 2p, чтобы получить четыре неспаренных электрона для образования четырёх связей с другими атомами
Как отмечалось в главе 11 и ранее в этой главе, углерод образует четыре связи. В метане он создаёт четыре электронные пары, совместно используемые с четырьмя атомами водорода. Каждый атом H вкладывает один электрон. Поэтому углерод должен иметь четыре неспаренных электрона для образования этих связей. Каждый неспаренный электрон углерода может объединиться с одним электроном водорода и образовать связывающую пару электронов. Чтобы иметь четыре неспаренных электрона, углерод «поднимает» 2 s -электрон на 2 p -орбиталь, как это показано в нижней части рис. 14.4. У изолированного атома углерода такая конфигурация не возникает, если только не передать ему значительное количество энергии. Для атома углерода перемещение 2 s -электрона на 2 p -орбиталь — это переход к конфигурации с повышенной энергией. Однако в случае, когда атомы образуют молекулы, электроны и ядра различных атомов влияют друг на друга. Представьте себе четыре атома H, приближающихся к атому C. Теперь система стремится перейти в низшее энергетическое состояние для всех пяти атомов. Образование четырёх связей уменьшает эту энергию сильнее, чем её повышает переход 2 s -электрона на 2 p -орбиталь.
Гибридные атомные орбитали: линейные молекулы
Итак, мы разобрались, каким образом углерод образует четыре связи, необходимые для молекулы метана. Но почему она имеет тетраэдрическую форму? Три 2 p -орбитали — это p x , p yи p z. Эти три орбитали перпендикулярны друг другу, то есть для любой их пары угол между ними составляет 90°. Если бы три атома H были связаны с 2 p -орбиталями, то угол между связями должен был составлять 90°. Далее, 2 s -орбиталь сферическая. 1 s -орбиталь четвёртого атома H должна была бы объединиться с углеродной 2 s -орбиталью. Если бы больше ничего не происходило, то ясно, что использование 2 s -орбитали и трёх 2 p -орбиталей углерода не привело бы к появлению у метана четырёх совершенно идентичных C−H-связей в тетраэдрической конфигурации. Кроме того, каким образом углерод образует треугольную молекулу формальдегида или линейную молекулу углекислого газа O=C=O? Во всех этих конфигурациях — тетраэдрической, треугольной и линейной — углеродные связи задействуют всё те же 2 s - и 2 p -орбитали.
В формальдегиде и углекислом газе имеются двойные связи, которых мы вскоре коснёмся. Чтобы разобраться в важных свойствах атомных орбиталей, которые могут придавать молекулам линейную, треугольную или тетраэдрическую форму, мы рассмотрим химические связи в гидриде бериллия BeH 2, бора́не BH 3и метане CH 4. Бериллий и бор в молекулах BeH 2и BH 3не имеют замкнутой оболочки, как у инертного газа неона, поэтому они химически очень активны. Создать эти молекулы можно, но они будут реагировать буквально со всем, с чем вступают в контакт, образуя новые молекулы, в которых Be и B имеют замкнутые конфигурации оболочек. Здесь мы рассматриваем их лишь как удобные примеры.
Бериллий имеет два электрона сверх замкнутой электронной конфигурации гелия. У отдельного атома эти два электрона спарены на 2 s -орбитали. Они являются валентными электронами бериллия. В молекуле BeH 2каждый атом H имеет по одному электрону на 1 s -орбитали. Чтобы бериллий образовал две пары электронных связей, по одной для каждого атома H, он должен поднять один из 2 s -электронов на 2 p -орбиталь, которую мы примем за 2 p z, как показано в верхней части рис. 14.5.
Читать дальше














