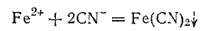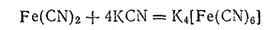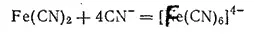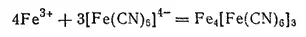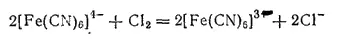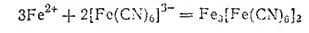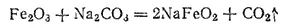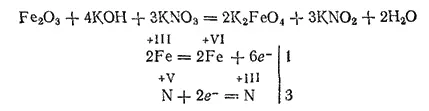При прокаливании гидроксид железа (III), теряя воду, переходит в оксид железа (III), или окись железа, Fe 2O 3. Оксид железа (III) встречается в природе в виде красного железняка и применяется как коричневая краска — железный сурик, или мумия.
Характерной реакцией, отличающей соли железа (III) от солей железа (II), служит действие роданида калия KSCN или роданида аммония NH 4SCN на соли железа. Раствор роданида калия содержит бесцветные ионы SCN -, которые соединяются с ионами Fe(III), образуя кроваво-красный, слабо диссоциированный роданид железа(III) Fe(SCN) 3. При взаимодействии же с роданидами ионов железа (II) раствор остается бесцветным.
Цианистые соединения железа. При действии на растворы солей железа (II) растворимых цианидов, например цианида калия, получается белый осадок цианида железа(II):
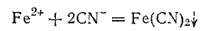
В избытке цианида калия осадок растворяется вследствие образования комплексной соли K 4[Fe(CN) 6] гексацианоферрата (II) калия
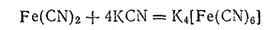
или
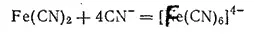
Гексацианоферрат(II) калия K 4[Fe(CN) 6]·3H 2O кристаллизуется в виде больших светло-желтых призм. Эта соль называется также желтой кровяной солью. При растворении в воде соль диссоциирует на ионы калия и чрезвычайно устойчивые комплексные ионы [Fe(CN) 6] 4-. Практически такой раствор совершенно не содержит ионов Fe 2+и не дает реакций, характерных для железа(II).
Гексацианоферрат (II) калия служит чувствительным реактивом на ионы железа(III), так как ионы [Fe(CN) 6] 4-, взаимодействуя с ионами Fe 3+, образуют нерастворимую в воде соль гексацианоферрат(II) железа (III) Fe 4[Fe(CN) 6] 3характерного синего цвета; эта соль получила название берлинской лазури:
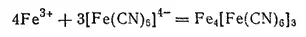
Берлинская лазурь применяется в качестве краски.
При действии хлора или брома на раствор желтой кровяной соли анион ее окисляется, превращаясь в [Fe(CN) 6] 3-
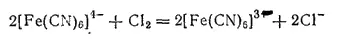
Соответствующая этому аниону соль K 3[Fe(CN) 6] называется гексацианоферратом(III) калия, или красной кровяной солью. Она образует красные безводные кристаллы.
- 671 -
Если подействовать гексацианоферратом(III) калия на раствор соли железа(II), то получается осадок гексацианоферрата (III), железа (И) (турнбулева синь), внешне очень похожий на берлинскую лазурь, но имеющий иной состав:
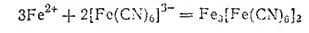
С солями железа (III) K 3[Fe(CN) 6] образует зеленовато-бурый раствор.
В большинстве других комплексных соединений, как и в рассмотренных цианоферратах, координационное число железа(II) и железа(III) равно шести.
Ферриты. При сплавлении оксида железа(III) с карбонатами натрия или калия образуются ферриты — соли не полученной в свободном состоянии железистой кислоты HFeO 2, например феррит натрия NaFeO 2:
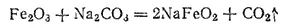
В технике ферритами или ферритными материалами называют продукты спекания порошков оксида железа(III) и оксидов некоторых двухвалентных металлов, например никеля, цинка, марганца. Спекание производится при 1000-1400°C. Ферриты обладают ценными магнитными свойствами и высоким электрическим сопротивлением, что обусловливает небольшую величину электрических потерь в них. Ферриты широко применяются в технике связи, счетно-решающих устройствах, в автоматике и телемеханике.
Соединения железа(VI).
Если нагревать стальные опилки или оксид железа(III) с нитратом и гидроксидом калия, то образуется сплав, содержащий феррат калия K 2FeO 4— соль железной кислоты H 2FeO 4:
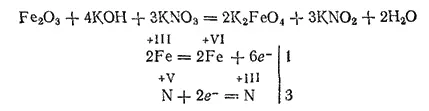
При растворении сплава в воде получается красно-фиолетовый раствор, из которого действием хлорида бария можно осадить нерастворимый в воде феррат бария BaFeO 4.
Все ферраты — очень сильные окислители (более сильные, чем перманганаты). Соответствующая ферратам железная кислота H 2FeO 4и ее ангидрид FeO 3в свободном состоянии не получены.
Читать дальше
Конец ознакомительного отрывка
Купить книгу