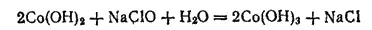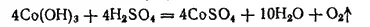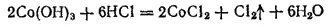Карбонилы железа. Железо образует летучие соединения с оксидом углерода, называемые карбонилами железа. Пентакарбонил железа Fe(CO) 5представляет собой бледно-желтую жидкость, кипящую при 105°C, нерастворимую в воде, но растворимую во многих органических растворителях. Fe(CO) 5получают пропусканием СО над порошком железа при 150-200°C и давлении 10 МПа. Примеси, содержащиеся в железе, не вступают в реакции с СО, вследствие чего получается весьма чистый продукт. При нагревании в вакууме пентакарбонил железа разлагается на железо и СО; это используется для получения высокочистого порошкового железа — карбонильного железа (см. § 193).
Природа химических связей в молекуле Fe(CO) 5рассмотрена на стр. 430.
- 672 -
В природе кобальт мало распространен: содержание его в земной коре составляет около 0,004; (масс.). Чаще всего кобальт встречается в соединении с мышьяком в виде минералов кобальтовый шпейс CoAs 2и кобальтовый блеск CaAs.
Кобальт — твердый, тягучий, похожий на железо блестящий металл. Как и железо, он обладает магнитными свойствами. Вода и воздух на него не действуют. В разбавленных кислотах кобальт растворяется значительно труднее, чем железо.
Кобальт применяется главным образом в сплавах, которые используются в качестве жаропрочных и жаростойких материалов, для изготовления постоянных магнитов и режущих инструментов. Жаропрочный и жаростойкий сплав виталлиум содержит 60% Co, 28% Cr, 3% W и 4% Mo. Этот сплав сохраняет высокую прочность и не поддается коррозии при температурах до 800-850°C. Твердые сплавы стеллиты, содержащие 40-60% Co, 20-35% Cr, 5-20% W и 1-2% C, применяются для изготовления режущего инструмента. Кобальт входит также в состав керамикометаллических твердых сплавов — керметов (см. стр. 639). Соединения кобальта придают стеклу темно-синюю окраску (вследствие образования силиката кобальта). Такое стекло, истолченное в порошок, употребляется под названием «шмальты» или «кобальта» в качестве синей краски. Радиоактивный изотоп 60Co применяется в медицине как источник γ-излучения («кобальтовая пушка»).
Кобальт образует оксид кобальта(II), или закись кобальта, CoO и оксид кобальта (III), или окись кобальта, Co 2O 3, которым соответствуют гидроксиды Co(OH) 2и Co(OH) 3. Этим соединениям отвечают два ряда солей, но соли кобальта(III) нестойки и легко переходят в соли кобальта(II). Известен также смешанный оксид Co 3O 4(или CoO·Co 2O 3).
Соли кобальта(II) в безводном состоянии обычно синего цвета, а их водные растворы и кристаллогидраты имеют розовый цвет; например, хлорид кобальта (II) образует розовые кристаллы состава CoCl 2·6H 2O. Фильтровальная бумага, пропитанная раствором этой соли и потом высушенная, может служить грубым гигроскопом (указателем влажности), так как в зависимости от содержания влаги в воздухе принимает разные оттенки цветов — от синего до розового.
Гидроксид кобальта(II) Co(OH) 2получается при действии щелочи на растворы солей кобальта(II). Вначале выпадает осадок синей основной соли, который при кипячении жидкости переходит в розовый гидроксид Co(OH) 2; последний при прокаливании дает оксид кобальта (II) CoO серо-зеленого цвета.
Соединения кобальта (II) окисляются с большим трудом, чем соединения железа(II) так, гидроксид кобальта(II) окисляется на воздухе в темно-бурый гидроксид кобальта (III) Co(OH) 3гораздо медленнее, чем происходит аналогичное превращение гидроксидов железа.
- 673 -
Однако в присутствии сильных окислителей, например гипохлорита натрия, окисление Co(OH) 2в Co(OH) 3протекает быстро:
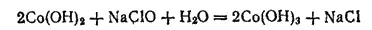
При действии на гидроксид кобальта (III) кислородсодержащих кислот соли кобальта (III) не образуются, а выделяется кислород и получаются соли кобальта (II), например:
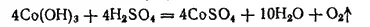
Из соляной кислоты гидроксид кобальта (III) выделяет хлор:
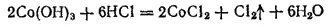
Таким образом, соединения Co(III) менее устойчивы, чем соединения железа(III), и проявляют более сильно выраженную окислительную способность.
Для кобальта (III) очень характерна его способность к комплексообразованию. Комплексные соединения кобальта (II) хотя и известны, но очень неустойчивы. В комплексных солях кобальт может входить как в состав катиона, так и в состав аниона, например [Co(NH 3) 6]Cl 3и K 3[Co(NO 2) 6]. Координационное число кобальта равно шести.
Читать дальше
Конец ознакомительного отрывка
Купить книгу