В 20-х годах была дана качественная трактовка реакций присоединения к насыщенным молекулам, структуры ряда комплексных соединений, а также в первом приближении объяснена природа водородной связи. Это удалось сделать с помощью выдвинутой Льюисом и развитой впоследствии Сиджвиком [78, 79] концепции неподеленной (свободной) электронной пары, способной образовывать химические связи.
Значение появления этой концепции трудно переоценить. Если в конце XIX — начале XX вв. для объяснения существования многих комплексных соединений и протекания реакций присоединения к насыщенным молекулам приходилось прибегать к искусственным представлениям о "дополнительных" (скрытых, побочных) валентностях, то с появлением модели Льюиса и концепции неподеленных электронных пар необходимость в подобных построениях отпала. По словам Сиджвика: "обе ветви химии — органическая и неорганическая — получили благодаря введению электронных представлений единый теоретический фундамент" [79, с. 468].
Развитие теории ковалентной связи Ленгмюром
Большая заслуга в разработке и пропаганде идей Льюиса принадлежит американскому физикохимику Ирвингу Ленгмюру. По образному замечанию американского историка химии М. Зальцмана: "если бы не Ленгмюр, то ключ к химической связи оказался бы надолго зарытым в химической литературе" [77].
Основные идеи своей работы [57] Ленгмюр выразил в одиннадцати постулатах, большая часть которых относится к строению электронной оболочки. Модель Ленгмюра, так же как и модель Льюиса, — электростатическая. Оба автора пытаются связать ее с ранней моделью Томсона. Но у теории Ленгмюра имеются некоторые преимущества, главное из которых — принцип заполнения электронных оболочек, которые Ленгмюр разбивает на "ячейки" (cells) . В каждой ячейке может находиться не более двух электронов [2] Исключение составляют только две ячейки первой оболочки, они могут вмещать только по одному электрону каждая.
. Следует заметить, что этот принцип заполнения электронных оболочек был распространен Ленгмюром на все известные тогда химические элементы. Но главное, что интересно в данной книге,- это его взгляд на природу химической связи. Ленгмюр выделяет два типа стабильных электронных конфигураций: электронную пару и октет. При образовании химической связи все валентные электроны участвуют в образовании октетов, либо переходя от одного атома к другому, либо путем образования общих электронных пар. Общее число электронов е, число октетов п и число электронных пар р , "удерживаемых сообща (hold... in common) октетами", Ленгмюр связал формулой 2р = 8т — е.
На рис. 1 показаны некоторые схемы электронного строения молекул, взятые из работы [57].
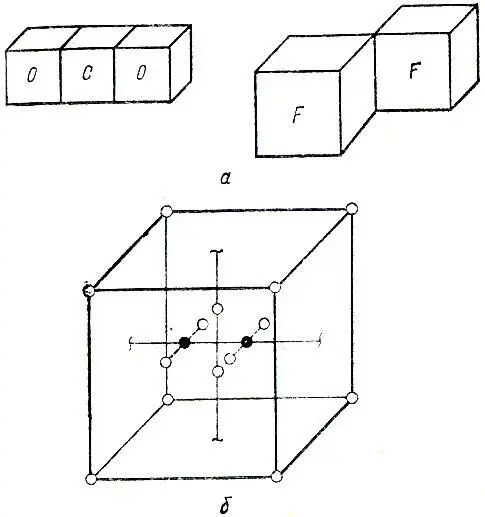
Рис. 1. Электронные модели молекул по Ленгмюрум. а — молекулы СО 2и F 2, б — молекула N 2
Особого внимания заслуживает десятый постулат Ленгмюра, точнее, его вторая часть: "В исключительных случаях октет может образовываться около сложного ядра, т. е. около структуры, содержащей ядра двух атомов, удерживаемых вместе парой электронов" [57, с. 888].
Примером такого "исключительного случая" является молекула азота. Необычайная стабильность и химическая инертность этой молекулы была объяснена Ленгмюром тем, что она имеет следующее электронное строение: каждое ядро атома удерживает пару электронов первой оболочки (т. е., говоря современным языком, 1s-электроны не принимают участия в химической связи); восемь из оставшихся десяти электронов образуют октет (см. рис. 1, б ), внутри которого, между ядрами азота, находятся два электрона.
В этой же работе Ленгмюр впервые сформулировал принцип изоэлектронности (по его терминологии "изостерности"). В качестве одного из примеров изоэлектронных серий был рассмотрен ряд молекул: N 2, СО и CN -. Способ описания молекулы СО и аниона CN -такой же, как и молекулы N 2. В указанном отрывке из 10-го постулата и приведенных примеров можно видеть начало принципиально нового способа описания молекул, которому в квантовой химии соответствует метод молекулярных орбиталей. Разумеется, речь идет не о детальном сходстве, а об аналогии в самой постановке задачи изучения электронной структуры молекулы. Суть этой аналогии заключается в том, что и в методе молекулярных орбиталей (МО), и в отдельных построениях Ленгмюра молекула рассматривается как "многоядерный атом", т. е. допускается, что при решении молекулярной задачи можно применить принципы, подобные тем, которые используются в теории атома при анализе заполнения электронных оболочек атомов элементов.
Читать дальше












