1 ...6 7 8 10 11 12 ...49 К • [Н 2O] = К (Н 2O ) = [Н +] • [OH¯] = 10 -14(22°C).
Ионное произведение воды– произведение концентраций [Н +] и [OH¯] – есть величина постоянная при постоянной температуре и равная 10 -14при 22°C.
Ионное произведение воды увеличивается с увеличением температуры.
Водородный показатель рН– отрицательный логарифм концентрации ионов водорода: рН = – lg[H +]. Аналогично: pOH = – lg[OH¯].
Логарифмирование ионного произведения воды дает: рН + рOH = 14.
Величина рН характеризует реакцию среды.
Если рН = 7, то [Н +] = [OH¯] – нейтральная среда.
Если рН < 7, то [Н +] > [OH¯] – кислотная среда.
Если рН > 7, то [Н +] < [OH¯] – щелочная среда.
Буферные растворы – растворы, имеющие определенную концентрацию ионов водорода. рН этих растворов не меняется при разбавлении и мало меняется при добавлении небольших количеств кислот и щелочей.
I. Раствор слабой кислоты НА, концентрация – с кисл, и ее соли с сильным основанием ВА, концентрация – с соли. Например, ацетатный буфер – раствор уксусной кислоты и ацетата натрия: CH 3COOH + CHgCOONa.
рН = рК кисл+ lg(с соли/с кисл).
II. Раствор слабого основания ВOH, концентрация – с осн, и его соли с сильной кислотой ВА, концентрация – с соли. Например, аммиачный буфер – раствор гидроксида аммония и хлорида аммония NH 4OH + NH 4Cl.
рН = 14 – рК осн– lg(с соли/с осн).
Гидролиз солей– взаимодействие ионов соли с водой с образованием слабого электролита.
Примеры уравнений реакций гидролиза.
I. Соль образована сильным основанием и слабой кислотой:
Na 2CO 3+ H 2O ↔ NaHCO 3+ NaOH
2Na ++ CO 3 2-+ H 2O ↔ 2Na ++ HCO 3¯ + OH¯
CO 3 2-+ H 2O ↔ HCO 3¯ + OH¯, pH > 7, щелочная среда.
По второй ступени гидролиз практически не идет.
II. Соль образована слабым основанием и сильной кислотой:
AlCl 3+ H 2O ↔ (AlOH)Cl 2+ HCl
Al 3++ ЗCl¯ + H 2O ↔ AlOH 2++ 2Cl¯ + Н ++ Cl¯
Al 3++ H 2O ↔ AlOH 2++ Н +, рН < 7.
По второй ступени гидролиз идет меньше, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и сильной кислотой:
KNO 3+ H 2O ≠
К ++ NO 3¯ + Н 2O ≠ нет гидролиза, рН ≈ 7.
IV. Соль образована слабым основанием и слабой кислотой:
CH 3COONH 4+ H 2O ↔ CH 3COOH + NH 4OH
CH 3COO¯ + NH 4 ++ H 2O ↔ CH 3COOH + NH 4OH, рН = 7.
В ряде случаев, когда соль образована очень слабыми основаниями и кислотами, идет полный гидролиз. В таблице растворимости у таких солей символ – «разлагаются водой»:
Al 2S 3+ 6Н 2O = 2Al(OH) 3↓ + 3H 2S↑
Возможность полного гидролиза следует учитывать в обменных реакциях:
Al 2(SO 4) 3+ 3Na 2CO 3+ 3H 2O = 2Al(OH) 3↓ + 3Na 2SO 4+ 3CO 2↑
Степень гидролиза h – отношение концентрации гидролизованных молекул к общей концентрации растворенных молекул.
Для солей, образованных сильным основанием и слабой кислотой:
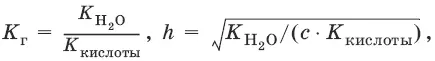
[OH¯] = ch, рOH = – lg[OH¯], рН = 14 – рOH.
Из выражения следует, что степень гидролиза h (т. е. гидролиз) увеличивается:
а) с увеличением температуры, так как увеличивается K(H 2O);
б) с уменьшением диссоциации кислоты, образующей соль: чем слабее кислота, тем больше гидролиз;
в) с разбавлением: чем меньше с, тем больше гидролиз.
Для солей, образованных слабым основанием и сильной кислотой
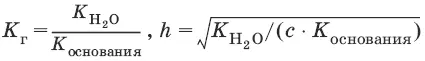
[Н +] = ch, рН = – lg[H +].
Для солей, образованных слабым основанием и слабой кислотой
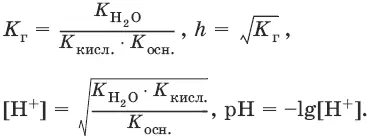
6.8. Протолитическая теория кислот и оснований
Протолиз – процесс передачи протона.
Протолиты – кислоты и основания, отдающие и принимающие протоны.
Кислота– молекула или ион, способные отдавать протон. Каждой кислоте соответствует сопряженное с нею основание. Сила кислот характеризуется константой кислоты К к.
Н 2CO 3+ Н 2O ↔ Н 3O ++ HCO 3¯
К к= 4 × 10 -7
[Al(Н 2O) 6] 3++ Н 2O ↔ [Al(Н 2O) 5OH] 2++ Н 3O +
К к= 9 × 10 -6
Основание– молекула или ион, способные принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания К 0.
NH 3 × Н 2O (Н 2O) ↔ NH 4 ++ OH¯
К 0= 1,8 ×10 -5
Амфолиты– протолиты, способные к отдаче и к присоединению протона.
HCO 3¯ + H 2O ↔ Н 3O ++ CO 3 2-
HCO 3¯ – кислота.
HCO 3¯ + H 2O ↔ Н 2CO 3+ OH¯
Читать дальше
Конец ознакомительного отрывка
Купить книгу

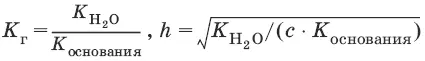
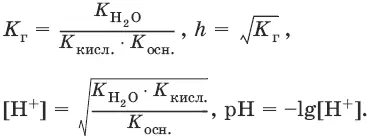







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



