1 ...8 9 10 12 13 14 ...49 
Комплекс парамагнитный, высокоспиновый, внешнеорбитальный, нестабильный (использованы внешние 4d-орбитали), октаэдрический ( sp 3d 2 -гибридизация).
Диссоциация координационных соединений.
Координационные соединения в растворе полностью диссоциируют на ионы внутренней и внешней сфер.
[Ag(NH 3) 2]NO 3 → Ag(NH 3) 2 ++ NO 3¯, α = 1.
Ионы внутренней сферы, т. е. комплексные ионы, диссоциируют на ионы металла и лиганды, как слабые электролиты, по ступеням.
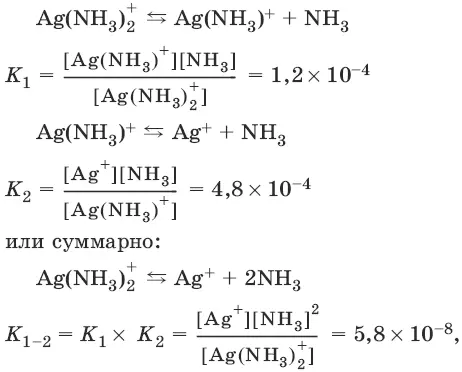
где K 1, К 2 , К 1_ 2 называются константами нестойкостии характеризуют диссоциацию комплексов: чем меньше константа нестойкости, тем меньше диссоциирует комплекс, тем он устойчивее.
1. Основные классы неорганических соединений
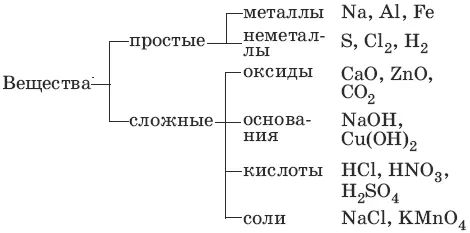
Оксиды– сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента.
Номенклатура: Fe 2O 3– оксид железа(III), Cl 2O – оксид хлора(I).
Классификация оксидов
Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N 2O.
Солеобразующие оксиды:
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Получение оксидов
Горение простых веществ:
С + O 2= CO 2
2Са + O 2= 2СаО
Горение (обжиг) сложных веществ:
CH 4+ 2O 2= CO 2+ 2Н 2O
4FeS 2+ 11O 2= 2Fe 2O 3+ 8SO 2
Разложение сложных веществ:
CaCO 3 → t → СаО + CO 2
2Fe(OH) 3→ t → Fe 2O 3+ ЗН 2O
Химические свойства оксидов
Основным оксидам (Na 2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н 2O = Са(OH) 2(растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н 2O ≠ (оксиды остальных металлов нерастворимы)
СаО + CO 2= CaCO 3
СаО + 2HCl = CaCl 2+ Н 2O
Кислотным оксидам(CO 2, Р 2O 5, СrO 3, Mn 2O 7) соответствуют кислоты.
SO 2+ Н 2O = H 2SO 3(кислотные оксиды, кроме SiO 2, растворимы в воде)
SO 2+ СаО = CaSO 3
SO 2+ 2NaOH = Na 2SO 3+ Н 2O
Амфотерным оксидам(ZnO, Al 2O 3, Cr 2O 3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H 2O ≠ (амфотерные оксиды нерастворимы в воде)
ZnO + 2HCl = ZnCl 2+ Н 2O
ZnO + 2NaOH → t → Na 2ZnO 2+ Н 2O (при нагревании или сплавлении)
ZnO + 2NaOH + H 2O = Na 2[Zn(OH) 4] (в разбавленном растворе)
Основания– сложные вещества, состоящие из атомов металла и гидроксиль-ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH) 3– гидроксид железа(III).
Классификация оснований:
– растворимые (щелочи) NaOH, KOH;
– нерастворимые Fe(OH) 2, Mg(OH) 2;
– амфотерные Zn(OH) 2, Al(OH) 3, Ве(OH) 2, Сr(OH) 3;
– однокислотные NaOH, KOH;
– двухкислотные Ва(OH) 2, Zn(OH) 2;
– трехкислотные Al(OH) 3, Сr(OH) 3.
Получение оснований
Получение щелочей:
2Na + 2Н 2O = 2NaOH + Н 2
Na 2O + Н 2O = 2NaOH
Получение нерастворимых и амфотер-ных оснований:
FeSO 4+ 2NaOH = Fe(OH) 2↓ + Na 2SO 4
AlCl 3+ 3NaOH = Al(OH) 3↓ + 3NaCl
Свойстващелочей:
NaOH → Na ++ OH¯ (α = 1, фенолфталеин – красный)
NaOH + HCl = NaCl + H 2O (реакция нейтрализации )
2NaOH + CO 2= Na 2CO 3+ H 2O
2NaOH + Zn(OH) 2= Na 2[Zn(OH) 4]
2NaOH + Al 2O 3→ t → 2NaAlO 2+ H 2O
2NaOH + CuSO 4= Cu(OH) 2↓ + Na 2SO 4
2NaOH + Zn + 2H 2O = Na 2[Zn(OH) 4] + H 2
2NaOH + 2Al + 6H 2O = 2Na[Al(OH) 4] + 3H 2
2NaOH + Si + H 2O = Na 2SiO 3+ 2H 2
Свойства нерастворимых оснований:
Fe(OH) 2 ↔ FeOH ++ OH¯ (α << 1);
FeOH + ↔ Fe 2++ OH‾ (α << 1)
Fe(OH) 2+ H 2SO 4= FeSO 4+ 2H 2O
Fe(OH) 2→ t → FeO + H 2O
Свойства амфотерных оснований:
Al 3++ ЗOH¯ + Н 2O ↔ Al(OH) 3↓ + Н 2O ↔ [Al(OH) 4]¯ + Н +
Al(OH) 3+ ЗHCl = AlCl 3+ ЗН 2O
Al(OH) 3+ NaOH = Na[Al(OH) 4]
2Al(OH) 3→ t → Al 2O 3+ ЗН 2O
Кислоты– сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.
Номенклатура кислот и кислотных остатков:
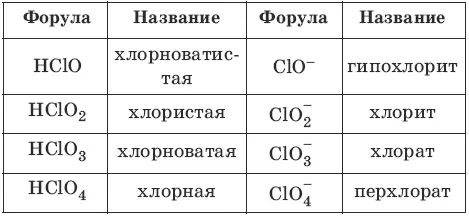
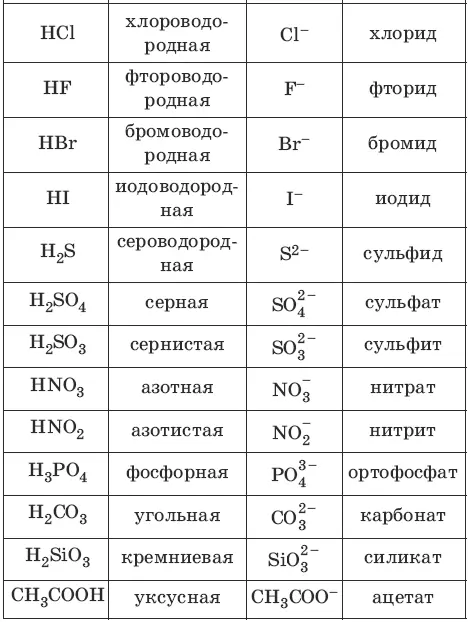
Классификация кислот:
– одноосновные HCl
Читать дальше
Конец ознакомительного отрывка
Купить книгу


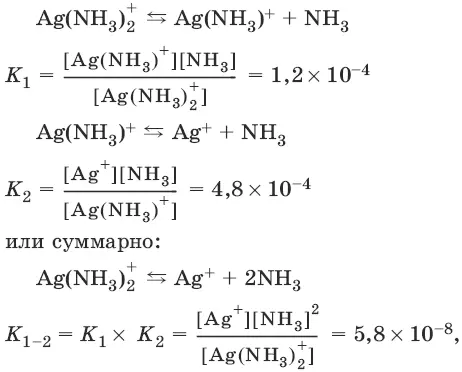










![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



