Электролиты можно разделить на сильные (α ~ 1) и слабые.
Сильные электролиты(для них α ~ 1) – соли и основания, растворимые в воде, а также некоторые кислоты: HNO 3, HCl, H 2SO 4, HI, HBr, HClO 4и другие.
Слабые электролиты(для них α << 1) – Н 2O, NH 4OH, малорастворимые основания и соли и многие кислоты: HF, H 2SO 3, H 2CO 3, H 2S, CH 3COOH и другие.
Ионные уравнения реакций. Вионных уравнениях реакций сильные электролиты записываются в виде ионов, а слабые электролиты, малорастворимые вещества и газы – в виде молекул. Например:
CaCO 3↓ + 2HCl = CaCl 2+ Н 2O + CO 2↑
CaCO 3↓ + 2H ++ 2Cl¯ = Са 2++ 2Cl¯ + Н 2O + CO 2↑
CaCO 3↓ + 2Н += Са 2++ Н 2O + CO 2↑
Реакции между ионамиидут в сторону образования вещества, дающего меньше ионов, т. е. в сторону более слабого электролита или менее растворимого вещества.
6.3. Диссоциация слабых электролитов
Применим закон действия масс к равновесию между ионами и молекулами в растворе слабого электролита, например уксусной кислоты:
CH 3COOH ↔ CH 3COО¯ + Н +
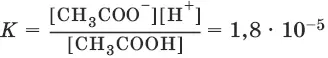
Константы равновесия реакций диссоциации называются константами диссоциации. Константы диссоциации характеризуют диссоциацию слабых электролитов: чем меньше константа, тем меньше диссоциирует слабый электролит, тем он слабее.
Многоосновные кислоты диссоциируют ступенчато:
Н 3PO 4 ↔ Н ++ Н 2PO 4¯
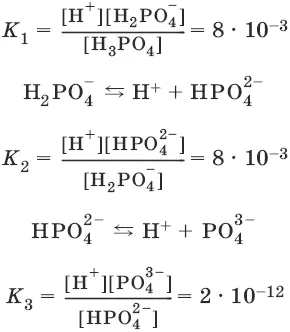
Константа равновесия суммарной реакции диссоциации равна произведению констант отдельных стадий диссоциации:
Н 3PO 4 ↔ ЗН ++ PO 4 3-
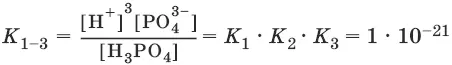
Закон разбавления Оствальда:степень диссоциации слабого электролита (а) увеличивается при уменьшении его концентрации, т. е. при разбавлении:
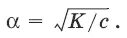
Влияние общего иона на диссоциацию слабого электролита:добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH 3COOH
CH 3COOH ↔ CH 3COО¯ + Н + α << 1
сильного электролита, содержащего общий с CH 3COOH ион, т. е. ацетат-ион, например CH 3COОNa
CH 3COОNa ↔ CH 3COО¯ + Na + α = 1
концентрация ацетат-иона увеличивается, и равновесие диссоциации CH 3COOH сдвигается влево, т. е. диссоциация кислоты уменьшается.
6.4. Диссоциация сильных электролитов
Активность иона а – концентрация иона, проявляющаяся в его свойствах.
Коэффициент активности f – отношение активности иона а к концентрации с: f = а/с или а =fc.
Если f = 1, то ионы свободны и не взаимодействуют между собой. Это имеет место в очень разбавленных растворах, в растворах слабых электролитов и т. д.
Если f < 1, то ионы взаимодействуют между собой. Чем меньше f, тем больше взаимодействие между ионами.
Коэффициент активности зависит от ионной силы раствора I: чем больше ионная сила, тем меньше коэффициент активности.
Ионная сила раствора I зависит от зарядов z и концентраций с ионов:
I = 0,52Σс • z 2.
Коэффициент активности зависит от заряда иона: чем больше заряд иона, тем меньше коэффициент активности. Математически зависимость коэффициента активности f от ионной силы I и заряда иона z записывается с помощью формулы Дебая-Хюккеля:
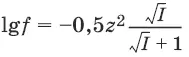
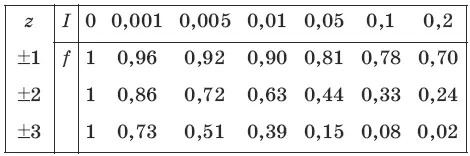
Коэффициенты активности ионов можно определить с помощью следующей таблицы:
6.5 Ионное произведение воды. Водородный показатель
Вода – слабый электролит – диссоциирует, образуя ионы Н +и OH¯. Эти ионы гидратированы, т. е. соединены с несколькими молекулами воды, но для простоты их записывают в негидратированной форме
Н 2O ↔ Н ++ OH¯.
На основании закона действия масс, для этого равновесия:
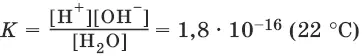
Концентрацию молекул воды [Н 2O], т. е. число молей в 1 л воды, можно считать постоянной и равной [Н 2O] = 1000 г/л : 18 г/моль = 55,6 моль/л. Отсюда:
Читать дальше
Конец ознакомительного отрывка
Купить книгу


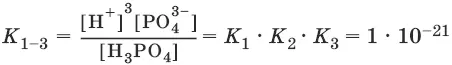
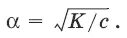
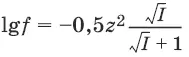

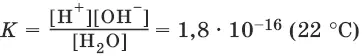







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



