Например, для F 2+ 2ē ↔ 2F¯ Е 0= 2,87 вольт, а для Na ++ 1ē ↔ Na 0 Е 0= -2,71 вольт (процесс всегда записывается для реакций восстановления).
Окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) Δ Е 0: Δ Е 0 = Δ Е 0 ок – Δ Е 0 восст , где Е 0 ок и Δ Е 0 восст – стандартные потенциалы окислителя и восстановителя для данной реакции.
Э.д.с. реакции Δ Е 0 связана с изменением свободной энергии Гиббса ΔG и константой равновесия реакции К:
ΔG = – nF Δ Е 0 или Δ Е = (RT/nF) ln K.
Э.д.с. реакции при нестандартных концентрациях Δ Е равна: Δ Е = Δ Е 0– (RT/nF) × Ig K или Δ Е = Δ Е 0– (0,059/ n )lg K .
В случае равновесия ΔG = 0 и ΔЕ = 0, откуда Δ Е = (0,059/n)lg K и К = 10 nΔE/0,059.
Для самопроизвольного протекания реакции должны выполняться соотношения: ΔG < 0 или К >> 1, которым соответствует условие Δ Е 0 > 0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение Δ Е 0. Если Δ Е 0 > 0, реакция идет. Если Δ Е 0< 0, реакция не идет.
Химические источники тока
Гальванические элементы– устройства, преобразующие энергию химической реакции в электрическую энергию.
Гальванический элемент Даниэля состоит из цинкового и медного электродов, погруженных в растворы ZnSO 4и CuSO 4соответственно. Растворы электролитов сообщаются через пористую перегородку. При этом на цинковом электроде идет окисление: Zn → Zn 2++ 2ē, а на медном электроде – восстановление: Cu 2++ 2ē → Cu. В целом идет реакция: Zn + CuSO 4= ZnSO 4+ Cu.
Анод – электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой.
Так, для реакции Zn + CuSO 4= ZnSO 4+ Cu схемой гальванического элемента является запись: (-)Zn | ZnSO 4|| CuSO 4| Cu(+).
Электродвижущая сила (э.д.с.) реакции равна Δ Е 0= Е 0 ок– Е 0 восст = Е 0 (Cu 2+/Cu) – Е 0 (Zn 2+/Zn) = 0,34 – (-0,76) = 1,10 В. Из-за потерь напряжение, создаваемое элементом, будет несколько меньше, чем Δ Е 0. Если концентрации растворов отличаются от стандартных, равных 1 моль/л, то Е 0 ок и Е 0 восст вычисляются по уравнению Нернста, а затем вычисляется э.д.с. соответствующего гальванического элемента.
Сухой элементсостоит их цинкового корпуса, пасты NH 4Cl с крахмалом или мукой, смеси MnO 2с графитом и графитового электрода. В ходе его работы идет реакция: Zn + 2NH 4Cl + 2MnO 2= [Zn(NH 3) 2]Cl + 2MnOOH.
Схема элемента: (-)Zn | NH 4Cl | MnO 2, C(+). Э.д.с. элемента – 1,5 В.
Аккумуляторы.Свинцовый аккумулятор представляет собой две свинцовые пластины, погруженные в 30%-ный раствор серной кислоты и покрытые слоем нерастворимого PbSO 4. При заряде аккумулятора на электродах идут процессы:
PbSO 4(тв) + 2ē → Рb(тв) + SO 4 2-
PbSO 4(тв) + 2H 2O → РbO 2(тв) + 4H ++ SO 4 2-+ 2ē
При разряде аккумулятора на электродах идут процессы:
РЬ(тв) + SO 4 2- → PbSO 4(тв) + 2ē
РbO 2(тв) + 4H ++ SO 4 2-+ 2ē → PbSO 4(тв) + 2Н 2O
Суммарную реакцию можно записать в виде:
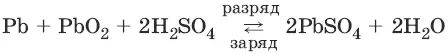
Для работы аккумулятор нуждается в регулярной зарядке и контроле концентрации серной кислоты, которая может несколько уменьшаться при работе аккумулятора.
6.1. Концентрация растворов
Массовая доля вещества в растворе w равна отношению массы растворенного вещества к массе раствора: w = m в-ва/m р-ра или w = m в-вa/(V × ρ ), так как m р-ра= V p-pa × ρ р-ра.
Молярная концентрация с равна отношению числа молей растворенного вещества к объему раствора: с = n (моль)/ V (л) или с = m/(М × V( л )).
Молярная концентрация эквивалентов (нормальная или эквивалентная концентрация) с эравна отношению числа эквивалентов растворенного вещества к объему раствора: с э= n (моль экв.)/ V (л) или с э= m/(М э × V(л)).
6.2. Электролитическая диссоциация
Электролитическая диссоциация– распад электролита на катионы и анионы под действием полярных молекул растворителя.
Степень диссоциации α– отношение концентрации диссоциированных молекул (с дисс) к общей концентрации растворенных молекул (с об): α = с дисс/с об.
Читать дальше
Конец ознакомительного отрывка
Купить книгу








![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



