1 ...7 8 9 11 12 13 ...49 HCO 3¯ – основание.
Для воды: Н 2O+ Н 2O ↔ Н 3O ++ OH¯
K(H 2O) = [Н 3O +][OH¯] = 10 -14и рН = – lg[H 3O +].
Константы К к и К 0 для сопряженных кислот и оснований связаны между собой.
НА + Н 2O ↔ Н 3O ++ А¯,
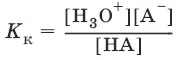
А¯ + Н 2O ↔ НА + OH¯,
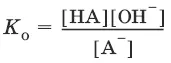
Отсюда
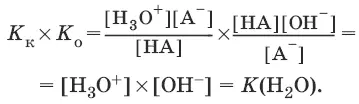
7. Константа растворимости. Растворимость
В системе, состоящей из раствора и осадка, идут два процесса – растворение осадка и осаждение. Равенство скоростей этих двух процессов является условием равновесия.
Насыщенный раствор– раствор, который находится в равновесии с осадком.
Закон действия масс в применении к равновесию между осадком и раствором дает:
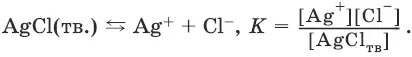
Поскольку [AgCl тв] = const,
К • [AgCl тв] = K s(AgCl) = [Ag +] • [Cl¯].
В общем виде имеем:
А m B n (тв.) ↔ m A +n+ n B -m
K s( A m B n) = [А +n ] m • [В -m ] n .
Константа растворимости K s (или произведение растворимости ПР) – произведение концентраций ионов в насыщенном растворе малорастворимого электролита – есть величина постоянная и зависит лишь от температуры.
Растворимость малорастворимого вещества s может быть выражена в молях на литр. В зависимости от величины s вещества могут быть разделены на малорастворимые – s < 10 -4моль/л, среднерастворимые – 10 -4моль/л ≤ s ≤ 10 -2моль/л и хорошо растворимые s >10 -2моль/л.
Растворимость соединений связана с их произведением растворимости.
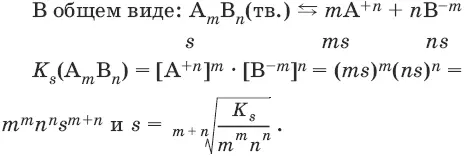
Условие осаждения и растворения осадка
В случае AgCl: AgCl ↔ Ag ++ Cl¯
K s = [Ag +] • [CI¯]:
а) условие равновесия между осадком и раствором: [Ag +] • [Cl¯] = K s.
б) условие осаждения: [Ag +] • [Cl¯] > K s; в ходе осаждения концентрации ионов уменьшаются до установления равновесия;
в) условие растворения осадка или существования насыщенного раствора: [Ag +] • [Cl¯] < K s; в ходе растворения осадка концентрация ионов увеличивается до установления равновесия.
8. Координационные соединения
Координационные (комплексные) соединения – соединения с донорно-акцеп-торной связью.
Для K 3[Fe(CN) 6]:
ионы внешней сферы – 3К +,
ион внутренней сферы – [Fe(CN) 6] 3-,
комплексообразователь – Fe 3+,
лиганды – 6CN¯, их дентатность – 1,
координационное число – 6.
Примеры комплексообразователей: Ag +, Cu 2+, Hg 2+, Zn 2+, Ni 2+, Fe 3+, Pt 4+и др.
Примеры лигандов: полярные молекулы Н 2O, NH 3, CO и анионы CN¯, Cl¯, OH¯ и др.
Координационные числа: обычно 4 или 6, реже 2, 3 и др.
Номенклатура. Называют сначала анион (в именительном падеже), затем катион (в родительном падеже). Названия некоторых лигандов: NH 3– аммин, Н 2O – акво, CN¯ – циано, Cl¯ – хлоро, OH¯ – гидроксо. Названия координационных чисел: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Указывают степень окисления комплек-сообразователя:
[Ag(NH 3) 2]Cl – хлорид диамминсеребра(I);
[Cu(NH 3) 4]SO 4– сульфат тетрамминмеди(II);
K 3[Fe(CN) 6] – гексацианоферрат(III) калия.
Химическаясвязь.
Теория валентных связей предполагает гибридизацию орбиталей центрального атома. Расположение образующихся при этом гибридных орбиталей определяет геометрию комплексов.
Диамагнитный комплексный ион Fe(CN) 6 4-.
Цианид-ион – донор
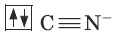
Ион железа Fe 2+– акцептор – имеет формулу 3d 64s 04p 0 . С учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d 2sp 3 -гибридизацию:
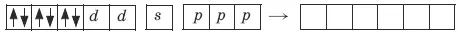
Комплекс диамагнитный, низкоспиновый, внутриорбитальный, стабильный (не используются внешние электроны), октаэд-рический ( d 2sp 3 -гибридизация).
Парамагнитный комплексный ион FeF 6 3-.
Фторид-ион – донор.
Ион железа Fe 3+– акцептор – имеет формулу 3d 54s 04p 0. С учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp 3d 2 -гибридизацию:
Читать дальше
Конец ознакомительного отрывка
Купить книгу

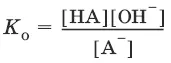
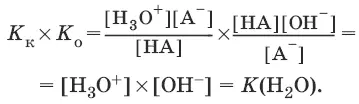
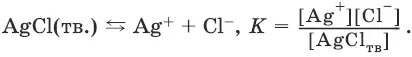
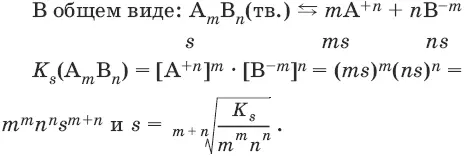
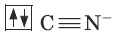
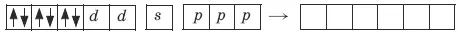







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



