AlCl 3+ 3NH 4OH = Al(OH) 3↓ + 3NH 4Cl
AlCl 3+ 3NaOH = Al(OH) 3↓ + 3NaCl
Al(OH) 3↓ + NaOH = Na[Al(OH) 4]
Al(OH) 3↓ + 3HCl = AlCl 3+ 3H 2O
2Al(OH) 3→ t → Al 2O 3+ 3H 2O
Соли алюминия гидролизуются. Некоторые из них (Al 2S 3, Al 2(CO 3) 3) полностью разлагаются водой.
Al 2S 3+ 6Н 2O = 2Al(OH) 3↓ + 3H 2S↑
Al 2(CO 3) 3+ ЗН 2O = 2Al(OH) 3↓+ 3CO 2↑
Элементы IVA-группы имеют электронную формулу ns 2np 2. Углерод и кремний являются неметаллами, германий, олово, свинец – металлами. Для элементов характерны степени окисления +4, +2, 0, -4 и валентность IV. В возбужденном состоянии атомы имеют конфигурацию ns 1np s, в этом состоянии для них характерна sp 3 -гибридизация.
5.1. Свойства углерода и его соединений
Характерные степени окисления углерода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
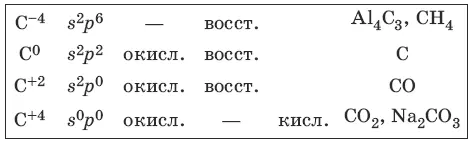
Свойства углерода
2С + O 2(недостаток) → t → 2CO
С + O 2(избыток) → t → CO 2
С + CO 2→ t → 2CO
С + CuO → t → Cu + CO
4С + Fe 3O 4→ t → 3Fe + 4CO
ЗС + СаО → t → СаС 2+ CO
2С + Са → t → СаС 2
ЗС + 4Al → t → Al 4С 3
С + 4НNO 3(конц.) → t → CO 2+ 4NO 2+ 2Н 2O
Свойства оксида углерода (II) – угарного газа
2CO + O 2→ t → 2CO 2
ЗCO + Fe 2O 3→ t → 2Fe + ЗCO 2
CO + CuO → t → Cu + CO 2
CO + H 2O → t, катализатор → CO 2+ Н 2
CO + NaOH → t, p → HCOONa
Свойства оксида углерода(IV) – углекислого газа
CaCO 3+ 2HCl = CaCl 2+ Н 2O + CO 2↑
CaCO 3→ t → СаО + CO 2
CO 2+ Н 2O ↔ Н 2CO 3 ↔ H ++ HCO 3¯ ↔ 2Н ++ CO 3 2-
CO 2+ Са(OH) 2= CaCO 3↓ + Н 2O
CO 2+ Н 2O + CaCO 3↓ = Са(HCO 3) 2
CO 2+ 2Mg → t → С + 2MgO
Свойства карбонатов и гидрокарбонатов
NaOH + CO 2= NaHCO 3
2NaOH + CO 2= Na 2CO 3+ H 2O
Са(HCO 3) 2→ 100 °C → CaCO 3↓ + Н 2O + CO 2↑
CaCO 3→ 1000 °C → СаО + CO 2
2NaHCO 3→ t → Na 2CO 3+ Н 2O + CO 2↑
NaHCO 3+ CH 3COOH = CH 3COONa + Н 2O + CO 2↑
CaCO 3+ Н 2O + CO 2= Са(HCO 3) 2
Са(HCO 3) 2+ Са(OH) 2= CaCO 3↓ + 2Н 2O
Na 2CO 3+ H 2O ↔ NaHCO 3+ NaOH
NaHCO 3+ (Н 2O) ↔ NaOH + (Н 2O) + CO 2
Свойства карбидов
СаС 2+ 2Н 2O = Са(OH) 2+ С 2Н 2
Al 4С 3+ 12HCl = 4AlCl 3+ ЗCH 4
5.2. Получение и свойства кремния и его соединений
Простое вещество
SiO 2+ 2Mg → t → Si + 2MgO
Si + O 2→ t → SiO 2
Si + 2F 2= SiF 4↑
Si + 2Mg → t → Mg 2Si
Si + 2KOH + 2H 2O = K 2SiO 3+ 2H 2
Силан SiH 4
Mg 2Si + 4HCl = 2MgCl 2+ SiH 4↑
SiH 4+ 2O 2= SiO 2+ 2Н 2O (самовоспламенение на воздухе)
Оксид кремния (IV)
SiO 2+ H 2O ≠
SiO 2+ 2NaOH → t, сплавление → Na 2SiO 3+ Н 2O
SiO 2+ 6HF = H 2[SiF 6] + 2H 2O
Кремниевая кислота и силикаты. Кремниевая кислота имеет полимерное строение и состав xSiO 2• yH 2O. H 2SiO 3– условная формула, такого соединения не выделено.
Na 2SiO 3+ 2HCl = H 2SiO 3↓ + 2NaCl
Na 2SiO 3+ 2Н 2O + 2CO 2= 2NaHCO 3+ H 2SiO 3↓
H 2SiO 3→ t → SiO 2+ H 2O
5.3. Получение и свойства соединений олова и свинца
Гидроксиды олова и свинца имеют амфо-терные свойства. При этом в степени окисления элемента +2 в гидроксидах преобладают основные свойства, а в степени окисления +4 – кислотные. Соединения Sn 2+имеют восстановительные свойства, а соединения РЬ 4+– окислительные:
SnCl 2+ 2NaOH = Sn(OH) 2↓ + 2NaCl
Sn(OH) 2↓ + 2HCl = SnCl 2+ 2H 2O
Sn(OH) 2↓ + 2NaOH = Na 2[Sn(OH) 4]
SnCl 4+ 4NH 4OH = H 2SnO 3↓ + 4NH 4Cl + H 2O
H 2SnO 3↓ + 2NaOH + H 2O = Na 2[Sn(OH) 6]
H 2SnO 3↓ + 4HCl = SnCl 4+ 3H 2O
SnCl 2+ 2FeCl 3= 2FeCl 2+ SnCl 4
PbO 2+ 4HCl = PbCl 2+ Cl 2↑ + 2H 2O
Элементы VA-группы имеют электронную формулу ns 2np s. Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э 2O 5имеют кислотные свойства, свойства оксидов Э 2O 3: кислотные – для N и Р, амфотерные – для As и Sb, основные – для Bi.
6.1. Получение и свойства азота и его соединений
Характерные степени окисления азота, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
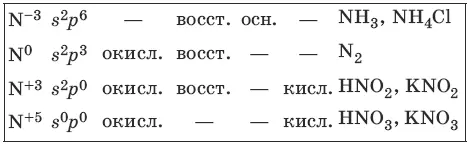
Простое вещество
NH 4NO 2→ t → N 2+ 2H 2O
N 2+ 6Li = 2Li 3N
N 2+ 3Ca → t → Ca 3N 2
N 2+ O 2→ t → 2NO
Соединения азота (-3)
N 2+ ЗН 2 → t, p, катализатор → 2NH 3
Ca 3N 2+ 6H 2O = ЗСа(OH) 2+ 2NH 3
2NH 4Cl + Са(OH) 2→ t → CaCl 2+ 2NH 3+ 2Н 2O
NH 3+ Н 2O ↔ NH 3• Н 2O ↔ NH 4 ++ OH¯
NH 3+ HCl = NH 4Cl
4NH 3+ CuSO 4= [Cu(NH 3) 4]SO 4
2NH 3• H 2O + AgCl = [Ag(NH 3) 2]Cl + 2H 2O
4NH 3• H 2O + Ag 2O = 2[Ag(NH 3) 2]OH + 3H 2O
4NH 3+ 3O 2= 2N 2+ 6H 2O
4NH 3+ 5O 2→ Pt, t → 4NO + 6H 2O
2NH 3+ 3CuO → t → 3Cu + N 2+ 3H 2O
NH 4Cl + NaOH = NaCl + NH 3+ H 2O
NH 4Cl → t → NH 3+ HCl
NH 4NO 2→ t → N 2+ 2H 2O
Читать дальше
Конец ознакомительного отрывка
Купить книгу










![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



