Cl 2+ 2KOH = KCl + KClO +Н 2O
2Cl 2+ 2Са(OH) 2= CaCl 2+ Са(ClO) 2+ 2Н 2O
Смесь CaCl 2и Са(ClO) 2– хлорная, или белильная, известь.
ЗCl 2+ 6KOH → 100 °C → 5KCl + KClO 3+ ЗН 2O
KClO 3– хлорат калия, или бертолетова соль.
4KClO 3→ 400 °C → KCl + ЗKClO 4
2KClO 3→ v →2KCl + 3O 2
Сила кислот растет в ряду:
HClO → HClO 2 → HClO 3 → HClO 4.
2HCl + Fe = FeCl 2+ H 2↑
2HCl + CuO = CuCl 2+ H 2O
3HCl + Al(OH) 3= AlCl 3+ 3H 2O
HCl + AgNO 3= AgCl↓ + HNO 3
HCl + NH 3= NH 4Cl
8.5. Бром, иод и их соединения
Бром – темно-бурая жидкость с резким запахом, а иод – кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного – дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор → бром → иод.
2NaBr + Cl 2= 2NaCl + Br 2
2NaI + Cl 2= 2NaCl + I 2
2Al + ЗBr 2= 2AlBr 3
2Al + 3I 2= 2AlI 3
Br 2+ Н 2 ↔ 2HBr
I 2+ Н 2 ^ 2Ш
AgNO 3+ NaBr = AgBr↓ + NaNO 3
AgNO 3+ NaI = AgI↓+ NaNO 3
I 2+ 2Na 2S 2O 3= 2NaI + Na 2S 4O 6
10KI + 8H 2SO 4+ 2KMnO 4= 5I 2+ 2MnSO 4+ 6K 2SO 4+ 8H 2O
В атомах d-элементов (переходных элементов) заполняется электронами d-под-уровень предвнешнего уровня. На внешнем уровне атомы d -элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро– и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент.
9.1. Хром и его соединения
Хром представляет собой ковкий тягучий металл серо-стального цвета. Электронная формула атома хрома 1s 22s 22p 63s 23p 63d 54s 1.
Характерные степени окисления хрома, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
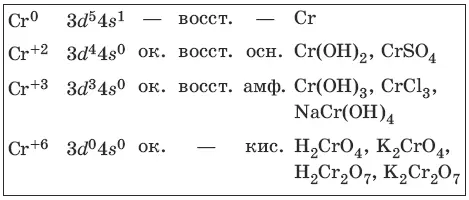
Получение и свойства хрома
FeO • Cr 2O 3+ 4CO → t → Fe + 2Cr + 4CO 2(Fe + 2Cr) – феррохром
Сr 2O 3+ 2Al → t → 2Сr + Al 2O 3– метод алюминотермии
Хром пассивируется на холоду концентрированными азотной и серной кислотами.
Сr + 2HCl = СrCl 2+ Н 2
СrCl 2+ 2NaOH = Cr(OH) 2↓ + 2NaCl
Свойства соединений хрома (+2) и хрома (+3)
Гидроксид хрома(II) сразу окисляется кислородом воздуха.
4Сr(OH) 2+ O 2+ 2Н 2O = 4Сr(OH) 3
СrCl 3+ 3NaOH = Cr(OH) 3↓ + 3NaCl
Cr(OH) 3↓ + 3Na(OH) = Na 3[Cr(OH) 6]
Cr 2O 3+ 2NaOH → t → 2NaCrO 2+ H 2O
Cr(OH) 3↓ + 3HCl = CrCl 3+ 3H 2O
2Cr(OH) 3→ t → Cr 2O 3+ 3H 2O
2CrCl 3+ 3Cl 2+ 16KOH = 2K 2CrO 4+ 12KCl + 8H 2O
2Na 3Cr(OH) 6+ 3Br 2+ 4NaOH = 2Na 2CrO 4+ 6NaBr + 8H 2O
Свойства соединений хрома (+6)
CrO 3+ Н 2O = H 2CrO 4
2CrO 3+ H 2O = H 2Cr 2O 7
Желтый раствор хромата калия устойчив в щелочной среде, оранжевый раствор дихромата калия – в кислой среде.
К 2Сr 2O 7+ 2KOH = 2К 2СrO 4+ Н 2O
2K 2CrO 4+ H 2SO 4= K 2SO 4+ K 2Cr 2O 7+ Н 2O
(NH 4) 2Cr 2O 7 → t → Cr 2O 3+ N 2+ 4Н 2O
Дихромат калия – окислитель в кислой среде.
К 2Сr 2O 7+ 4H 2SO 4+ 3Na 2SO 3= Cr 2(SO 4) 3+ 3Na 2SO 4+ K 2SO 4+ 4H 2O
K 2Cr 2O 7+ 4H 2SO 4+ 3NaNO 2= Cr 2(SO 4) 3+ 3NaNO 3+ K 2SO 4+ 4H 2O
K 2Cr 2O 7+ 7H 2SO 4+ 6KI = Cr 2(SO 4) 3+ 3I 2+ 4K 2SO 4+ 7H 2O
K 2Cr 2O 7+ 7H 2SO 4+ 6FeSO 4= Cr 2(SO 4) 3+ 3Fe 2(SO 4) 3+ K 2SO 4+ 7H 2O
9.2. Марганец и его соединения
Марганец – серебристо-белый твердый и хрупкий металл. Характерные степени окисления марганца, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.

Получение и свойства марганца
FeO • Mn 2O 3+ 4CO → t → Fe + 2Mn + 4CO 2(Fe + 2Mn) – ферромарганец
Mn 2O 3+ 2Al → t → 2Mn + Al 2O 3– метод алюминотермии
Mn + 2HCl = MnCl 2+ Н 2
Mn + 2H 2SO 4(конц.) = MnSO 4+ SO 2+ 2Н 2O
ЗMn + 8HNO 3(разб.) = 3Mn(NO 3) 2+ 2NO + 4Н 2O
Свойства соединений марганца (+2)
MnSO 4+ 2NaOH = Mn(OH) 2↓ + Na 2SO 4
Mn(OH) 2↓ + 2NaOH ≠
Mn(OH) 2↓ + H 2SO 4= MnSO 4+ 2H 2O
2Mn(OH) 2↓ + O 2= MnO 2↓ + 2H 2O
Mn(OH) 2↓ + 2NaOH + Br 2= MnO 2↓ + 2NaBr + 2H 2O
Mn(OH) 2↓ → t → MnO + H 2O↑
2Mn(NO 3) 2+ 16HNO 3+ 5NaBiO 3= 2HMnO 4+ 5Bi(NO 3) 3+ 5NaNO 3+ 7H 2O
3MnCl 2+ 2KClO 3+ 12NaOH → сплавление → 3Na 2MnO 4+ 2KCl + 6NaCl + 6H 2O
Свойства соединений марганца (+4)
MnO 2– устойчивый амфотерный оксид, сильный окислитель.
MnO 2+ 4HCl = MnCl 2+ Cl 2+ 2Н 2O
3MnO 2+ KClO 3+ 6KOH → сплавление → 3K 2MnO 4+ KCl + 3H 2O↑
Свойства соединений марганца (+6)
Соединения устойчивы лишь в сильнощелочной среде.
Читать дальше
Конец ознакомительного отрывка
Купить книгу










![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



