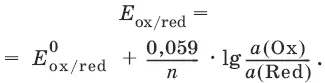
Если в окислительно-восстановительных реакциях принимают участие ионы водорода, то уравнение Нернста выглядит следующим образом:
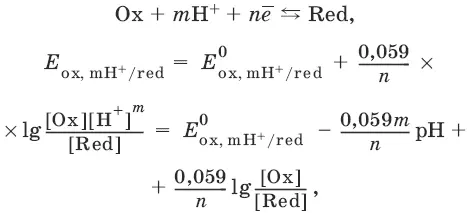
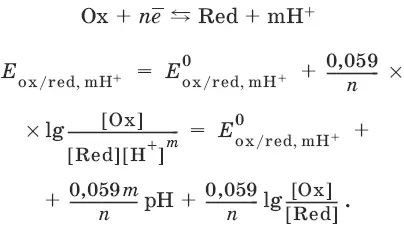
Если окисленная или восстановленная форма окислительно-восстановительной полуреакции является малорастворимым соединением, то в формулу для вычисления равновесного потенциала такой системы входит величина произведения растворимости этого соединения.
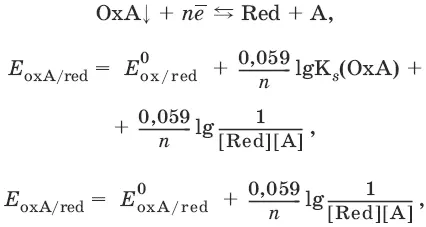
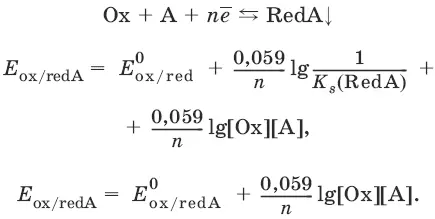
Если в окислительно-восстановительной полуреакции окисленной формой является комплексное соединение OxL m , характеризующееся константой устойчивости β(OxL m ), то равновесный окислительно-восстановительный потенциал вычисляется по уравнению:
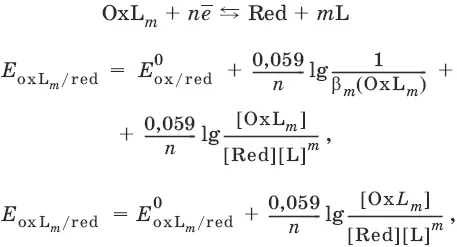
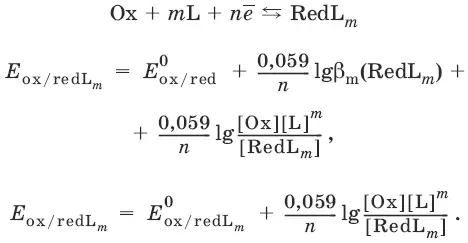
Направление и глубина протекания окислительно-восстановительных реакций.Обратимая окислительно-восстановительная реакция
аОх 1+ bRed 1 ↔ аОх 2+ bRed 2протекает в прямом направлении, если ΔЕ 0= Е 0 Ox1/Red2 – Е 0 Ox2/Red1> 0, И В обратном направлении, если ΔЕ 0< 0.
Глубина протекания реакции, т. е. степень превращения исходных веществ в продукты реакции, определяется константой равновесия.
Для окислительно-восстановительной реакции константа равновесия с потенциала-
ми участвующих в реакции редокс-пар связана уравнением:
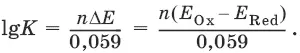
2. Качественные реакции катионов
Кислотно-основная классификация катионов
I группа:Li +, NH 4 +, Na +, K +
групповой реагент – отсутствует.
Свойства соединений: хлориды, сульфаты и гидроксиды растворимы в воде.
II группа:Ag +, Hg 2 2+, Pb 2+
групповой реагент – HCl ( с (HCl) = 2 моль/л).
Свойства соединений: хлориды не растворимы в воде.
III группа:Са 2+, Ва 2+, Sr 2+, Pb 2+
групповой реагент – H 2SO 4( c (H 2SO 4) = 2 моль/л).
Свойства соединений: сульфаты не растворимы в воде.
IV группа:Al 3+, Cr 3+, Zn 2+, As(III), As(IV), Sn 2+
групповой реагент – NaOH ( c (NaOH) = 2 моль/л), избыток.
Свойства соединений: гидроксиды растворимы в избытке NaOH.
V группа:Bi 3+, Fe 2+, Fe 3+, Mn 2+
групповой реагент – NH 3(конц.).
Свойства соединений: гидроксиды нерастворимы в избытке NaOH и NH 3.
VI группа:Cd 2+, Co 2+, Cu 2+, Ni 2+
групповой реагент – NH 4OH (конц.).
Свойства соединений: гидроксиды нерастворимы в избытке NaOH, но растворимы в избытке NH 3.
2.1. I аналитическая группа
Ион: Li +
1. Реактив, условия: Na 2HPO 4, конц. NH 3.
Уравнение реакции:
3LiCl + Na 2HPO 4= Li 3PO 4↓ + 2NaCl +HCl
Наблюдения: белый осадок.
2. Реактив, условия: Na 2CO 3, рН ≈ 7
Уравнение реакции: 2LiCl + Na 2CO 3= Li 2CO 3↓ + 2NaCl
Наблюдения: белый осадок.
Ион: NH 4 +
1. Реактив, условия: NaOH, газовая камера.
Уравнение реакции:
NH 4Cl + NaOH = NaCl + Н 2O + NH 3↑
Наблюдения: запах аммиака, фенолфталеиновая бумага краснеет.
2. Реактив, условия: реактив Несслера (смесь K 2[HgI 4] и KOH)
Уравнение реакции:
NH 3+ 2K 2[HgI 4] + ЗKOH = [OHg 2NH 2]I↓ + 7KI + 2Н 2O
Наблюдения: красно-бурый осадок.
Ион: Na +
1. Реактив, условия: K[Sb(OH) 6], насыщенный раствор, холод, рН ≈ 7, мешают NH 4 +, Li +
Уравнение реакции:
NaCl + K[Sb(OH) 6] = Na[Sb(OH) 6]↓ + KCl
Наблюдения: белый осадок.
2. Реактив, условия: Zn(UO 2) 3(CH 3COO) 8, предметное стекло, CH 3COOH, мешает Li +
Уравнение реакции:
NaCl + Zn(UO 2) 3(CH 3COO) 8+ CH 3COOK + 9Н 2O = NaZn(UO 2) 3(CH 3COO) 9 9Н 2O↓ + KCl
Наблюдения: желтые кристаллы октаэд-рической и тетраэдрической форм.
Ион: К +
1. Реактив, условия: Na 3[Co(NO 2) 6], слабо-кислая среда, мешают NH 4 +, Li +.
Уравнение реакции:
2KCl + Na 3[Co(NO 2) 6] = K 2Na[Co(NO 2) 6]↓ + 2NaCl
Наблюдения: желтый осадок.
2. Реактив, условия: NaHC 4H 4O 6, рН ≈ 7, мешает NH 4 +.
Читать дальше
Конец ознакомительного отрывка
Купить книгу

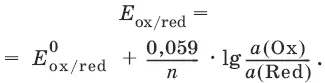
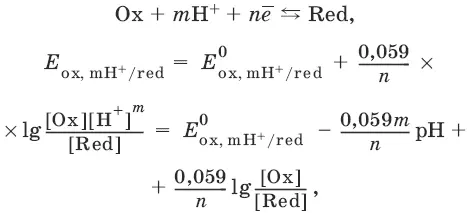
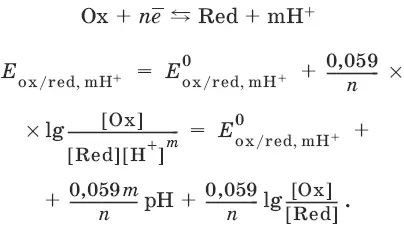
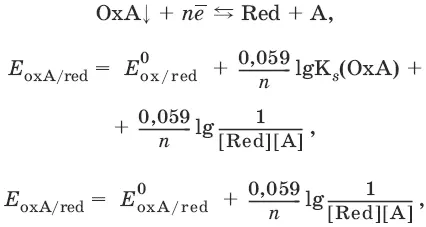
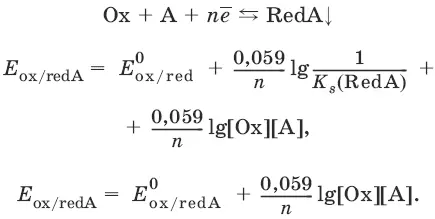
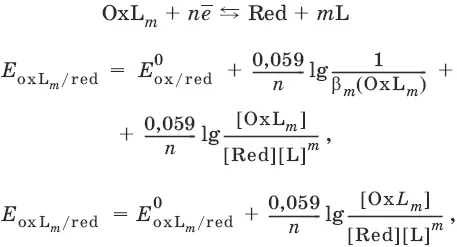
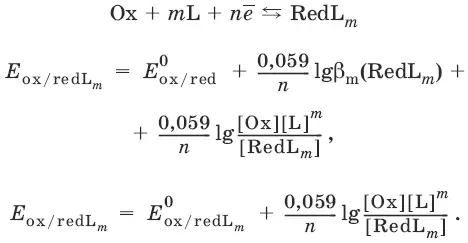
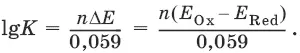







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



