3. Реактив, условия: соли кадмия(II), Cd(NO 3) 2
Уравнение реакции: S 2-+ Cd 2+= CdS↓
Наблюдения: желтый осадок.
3.3. III аналитическая группа
Ион: NO 3¯
Реактив, условия: дифениламин (C 6H 5) 2NH в H 2SO 4(конц.)
Наблюдения: темно-синее окрашивание на стенках пробирки.
Ионы: МoO 4 2-, WO 4 2-, VO 3¯
Реактив, условия: дифениламин (C 6H 5) 2NH в H 2SO 4(конц.)
Наблюдения: темно-синее окрашивание на стенках пробирки.
Ион: VO 3¯
1. Реактив, условия: Н 2O 2, эфир. Уравнение реакции:
VO 3¯ + Н 2O 2= VO 4¯ + Н 2O
Наблюдения: окрашивание органической фазы в оранжевый цвет.
2. Реактив, условия: лигнин (газетная бумага)
Наблюдения: лигнин, содержащийся в газетной бумаге, восстанавливает ион VO 3¯до низших степеней окисления, которые окрашивают газетную бумагу в черно-зеленый цвет.
Ион: CH 3COО¯
Реактив, условия: H 2SO 4(конц.)
Уравнение реакции:
CH 3COО¯ + Н += CH 3COOH
Наблюдения: запах уксуса.
4.1. Титриметрический (объемный) анализ
Молярная концентрация с э= n э/V, где n э – количество вещества эквивалентов, моль; V – объем раствора, л; единица измерения концентрации – моль/л.
Количество вещества эквивалента (n э) n э= m/M э= c э V, где m – масса вещества, г; M э – молярная масса эквивалента, г/моль, V – объем раствора, л.
Закон эквивалентов: n э(А) = n э(В) или
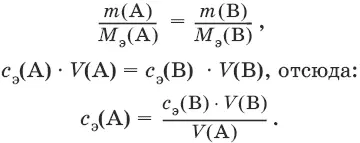
Титр – количество граммов растворенного вещества, содержащегося в 1 мл раствора.
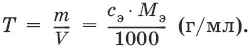
Титр по определяемому веществу – количество граммов определяемого вещества, которое реагирует с 1 мл титранта.
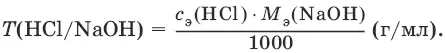
Прямое титрование – простейший прием титрования, заключающийся в том, что к определенному объему раствора определяемого вещества (А) по каплям приливают титрант (рабочий раствор) вещества (В).
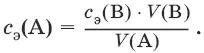
Обратное титрование – процесс титрования, при котором к определенному объему раствора определяемого вещества (А) приливают точно известный объем титранта (В 1), взятого в избытке. Избыток не вошедшего в реакцию вещества (В 1) оттитровывают раствором другого титранта (В 2) точно известной концентрации.
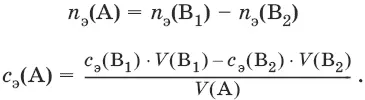
Заместительное титрование. Процесс титрования, при котором к определяемому веществу (А) прибавляют вспомогательное вещество (Р), реагирующее с ним с выделением эквивалентного количества нового вещества (А 1), которое оттитровывают соответствующим титрантом (В). Таким образом, вместо непосредственного титрования определяемого вещества (А) титруют его заместитель (А 1). Так как количества A и A 1эквивалентны, то количество вещества эквивалента определяемого вещества n э(А) равно количеству вещества эквивалента титранта n э(В):
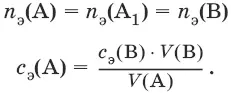
Уравнение реакции: Н ++ OH¯ → Н 2O или Н 3O ++ OH¯ → 2Н 2O.
Основные титранты (рабочие растворы): растворы сильных кислот (HCl или H 2SO 4) и сильных оснований (NaOH или KOH).
Установочные вещества (или первичные стандарты): тетраборат натрия Na 2B 4O 7 × 10 Н 2O, карбонат натрия Na 2CO 3, щавелевая кислота Н 2С 2O 4• 2Н 2O, янтарная кислота Н 2С 4Н 4O 4.
Индикаторы: кислотно-основные индикаторы (см. таблицу).
Характеристики некоторых индикаторов приведены в таблице.


Некоторые примеры кислотно-основного титрования
Титрование сильной кислоты сильным основанием
HCl + NaOH → NaCl + Н 2O
Н ++ OH¯ → Н 2O
В точке эквивалентности образуется соль сильной кислоты и сильного основания, которая не подвергается гидролизу. Реакция среды будет нейтральной (рН = 7). В данном случае индикатором может служить лакмус.
Читать дальше
Конец ознакомительного отрывка
Купить книгу

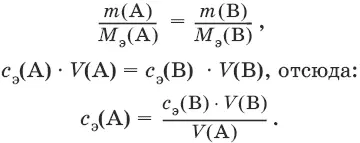
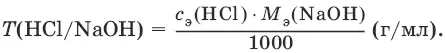
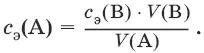
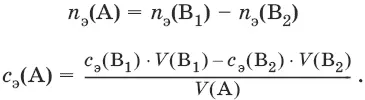
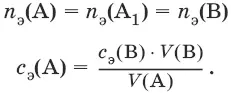









![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



