Титрование слабой кислоты сильным основанием
CH 3COOH + NaOH → CH 3COONa + Н 2O
CH 3COOH + OH¯ – > CHgCOO¯ + Н 2O
Образующаяся соль слабой кислоты и сильного основания в растворе подвергается гидролизу:
CH 3COO¯ + HOH → CH 3COOH + OH¯
Точка эквивалентности в этом случае будет находиться в щелочной среде, поэтому следует применять индикатор, меняющий окраску при рН < 7, например фенолфталеин.
Титрование слабого основания сильной кислотой
NH 4OH + HCl → NH 4Cl + Н 2O
NH 4OH + Н + → NH 4 ++ Н 2O
Образующаяся соль в растворе подвергается гидролизу:
NH 4 ++ HOH → NH 4OH + Н +
Точка эквивалентности будет находиться в кислой среде, поэтому можно применять индикатор, меняющий свою окраску при рН < 7, например метилоранж.
4.3. Метод комплексонометрии
Комплексонометрия – титриметриче-ский метод анализа, основанный на реакциях комплексообразования определяемых ионов металлов с некоторыми органическими веществами, в частности с комплексонами.
Комплексоны – аминополикарбоновые кислоты и их производные (соли).
В титриметрическом анализе широко используется один из представителей класса комплексонов – динатриевая соль этилендиаминтетрауксусной кислоты (Ма 2Н 2ЭДТА). Этот комплексон часто называют также трилоном Б или комплексном III:
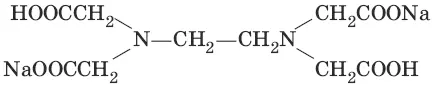
или [Na 2H 2ЭДTA]
Трилон Б со многими катионами металлов образует прочные, растворимые в воде внутрикомплексные соединения (хелаты). При образовании хелата катионы металла замещают два атома водорода в карбоксильных группах трилона Б и образуют координационные связи с участием атомов азота аминогрупп.
Уравнение реакции: Ме 2++ Н 2ЭДТА 2- → [МеЭДТА] 2-+ 2Н +
Основные титранты (рабочие растворы): трилон Б, MgSO 4, CaCl 2
Установочные вещества (или первичные стандарты): MgSO 4, CaCl 2
Индикаторы: металлохромные индикаторы, эриохром черный Т
При рН = 7-11 анион этого индикатора (HInd 2-) имеет синюю окраску. С катионами металлов (Са 2+, Mg 2+, Zn 2+и др.) в слабощелочном растворе в присутствии аммиачного буфера (рН = 8-10) он образует комплексные соединения винно-красного цвета по схеме:
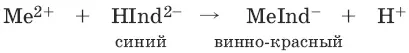
При титровании исследуемого раствора трилоном Б:
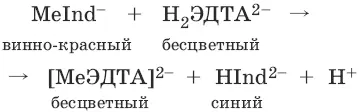
Константы нестойкости комплексов равны соответственно:
K н([CaInd]¯) = 3,9 • 10 -6
K н([СаЭДТА] 2-) = 2,7 • 10 -11
K н([MgInd]¯) = 1,0 •1 0 -7
K н([MgЭДTA] 2-) = 2,0 • 10 -9
4.4. Жесткость воды. Определение жесткости воды
Гидрокарбонатная (временная) жесткость обусловлена присутствием в воде бикарбонатов кальция и магния: Са(HCO 3) 2и Mg(HCO 3) 2. Она почти полностью устраняется при кипячении воды, так как растворимые гидрокарбонаты при этом разлагаются с образованием нерастворимых карбонатов кальция и магния и гидроксо-карбонатов магния:
Са(HCO 3) 2= CaCO 3↓ + CO 2↑ + H 2O
Mg(HCO 3) 2= MgCO 3↓ + CO 2↑ + H 2O
2Mg(HCO 3) 2= (MgOH) 2CO 3↓ + 3CO 2↑ + H 2O
Постоянная жесткость воды обусловлена присутствием в ней преимущественно сульфатов и хлоридов кальция и магния и при кипячении не устраняется.
Сумма величин временной и постоянной жесткости составляет общую жесткость воды:
Ж общ.= Ж вр.+ Ж пост.
Существуют различные способы определения жесткости воды: определение временной жесткости с помощью метода нейтрализации; комплексонометрический метод определения общей жесткости.
Гидрокарбонатная жесткость воды определяется титрованием воды раствором соляной кислоты в присутствии метилового оранжевого, так как рН в точке эквивалентности находится в области перехода окраски этого индикатора.
Са(HCO 3) 2+ 2HCl → CaCl 2+ 2Н 2CO 3
Mg(HCO 3) 2+ 2HCl → MgCl 2+ 2H 2CO 3
До начала титрования рН раствора гидрокарбонатов кальция и магния больше 7 за счет гидролиза солей с участием аниона слабой кислоты. В точке эквивалентности раствор имеет слабокислую реакцию, обусловленную диссоциацией слабой угольной кислоты:
Н 2CO 3↔ HCO 3¯ + Н +
Ж вр(Н 2O) = с э(солей) • 1000 (ммоль/л).
Общая жесткость воды (общее содержание ионов кальция и магния) определяется с использованием метода комплексонометрии.
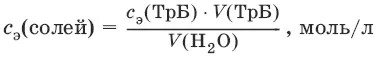
Ж пост(Н 2O) = с э(солей) • 1000 (ммоль/л).
Читать дальше
Конец ознакомительного отрывка
Купить книгу

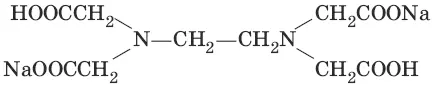
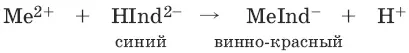
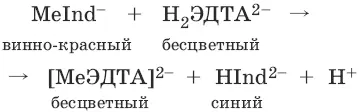
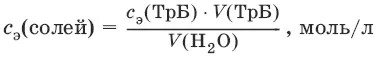







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



