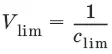
Минимальный объем предельно разбавленного раствора (V min) – наименьший объем (мл) раствора определяемого вещества, необходимый для его обнаружения данной реакцией.
m = C lim• V min• 10 6,
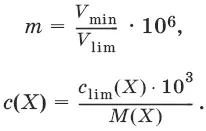
Вычисление рН водных растворов
сильных кислот: рН = – lg a (H +) = – lg ( c (H +) / f (Н +))
сильных оснований: рН = 14 + lg a (OH¯) = 14 + lg ( c (OH¯) f (OH¯))
слабых кислот: рН = – ½(р K кислоты– lg c ) = – ½K кислоты – ½ lg c
слабых оснований: рН = 14 – ½р K основания+ ½lg c
солей, образованных сильным основанием и слабой кислотой: рН = 7 + ½p K кислоты+ ½lg c соли
солей, образованных слабым основанием и сильной кислотой: рН = 7 – ½ K основания– lg c соли
солей, образованных слабым основанием и слабой кислотой: рН = 7 + ½p K кислоты+ ½p K основания
кислого буферного раствора:
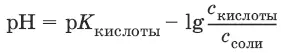
щелочного буферного раствора:
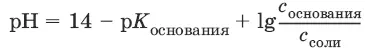
Вычисление буферной емкости.Емкость буферного раствора определяется количеством сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферного раствора, чтобы изменить его значение рН на единицу.

Гетерогенное равновесие: осадок – насыщенный раствор малорастворимого соединения.Гетерогенное равновесие между осадком малорастворимого соединения и его ионами в насыщенном водном растворе может быть представлено следующим уравнением:
Kt m An n ↓ ↔ mKt n ++ n An m -
[Kt n +] = m s ; [An m -] = n • s
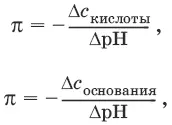
Константа равновесия обратимой реакции осаждения-растворения называется произведением растворимости K s (или ПР) и выражается следующим образом:
K s= a (Kt n +) m a (An m -) n = ( f (Kt n +) x [Kt n +]) m • ( f (An m- )[An m -]) n = ( ms) m(ns) n• f (Kt n +) m • f (An n -) n = n nm ms m+n • f (Kt n +) m • f (An m -) n , или K s= n n• m m• s m + n
Растворимость – это свойство вещества образовывать гомогенные системы с растворителем. Молярная растворимость малорастворимого вещества (s), моль/л, выражается следующим образом:
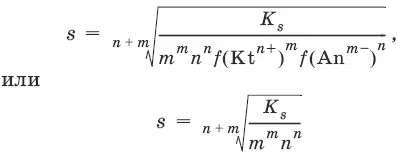
Зная молярную растворимость соединения Kt m An n , легко вычислить его растворимость в г/л ρ по формуле:
ρ = s • M(Kt m An n )
Массу малорастворимого вещества в любом объеме можно рассчитать по формуле:
m (Kt m An n ) = s(Kt m An n ) • M(Kt m An n ) x V р-ра
Условие образования и растворения осадка.Осадок не образуется или растворяется, если произведение концентраций ионов осадка в растворе меньше величины произведения растворимости.
[Kt n +] m [An m -] n < K s (Kt m An n )
Осадок образуется или выпадает, если произведение концентраций ионов осадка в растворе больше величины произведения растворимости.
[Kt n +] m [An m -] n > K s (Kt m An n ).
Равновесия в окислительно-восстановительных системах.Для обратимой окислительно-восстановительной реакции
Oх + nē ↔ Red
Равновесный потенциал E ox/ redсо стандартным потенциалом редокс-пары E ox/ redи активностью окисленной и восстановленной формы связан уравнением Нернста:
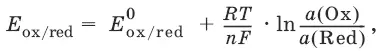
где R – универсальная газовая постоянная, равная 8,314 Дж/моль К, Т – температура по шкале Кельвина, К, T – число Фарадея, равное 96485 Кл/моль, а (Ох) – активность окисленной формы, a (Red) – активность восстановленной формы.
При подстановке в уравнение значений универсальной газовой постоянной, числа Фарадея, температуры Т = 298 К и замены натурального логарифма на десятичный получается уравнение для расчета значения равновесного электродного потенциала редокс-пары при 25°C:
Читать дальше
Конец ознакомительного отрывка
Купить книгу

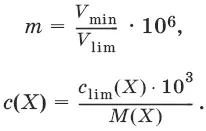
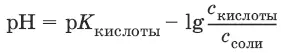
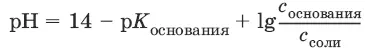


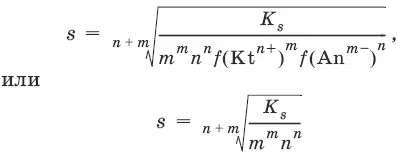
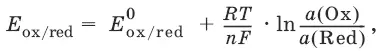







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



