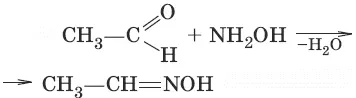
6. (образование дигалогенопроизводных)
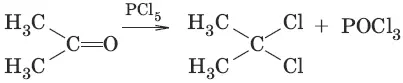
7. (α-галогенирование в присутствии OH¯)
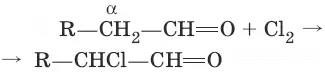
8. (албдольная конденсация)
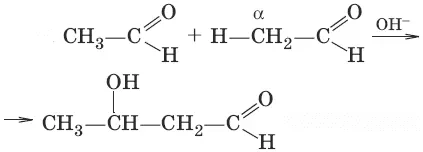
9. R—CH=O + Ag 2O → NH 3 → R—COOH + 2Ag↓ (окисление, реакция «серебряного зеркала»)
R—CH=O + 2Cu(OH) 2 → R—COOH + Cu 2O↓, + 2H 2O (красный осадок, окисление)
10. (окисление кетонов, жесткие условия)
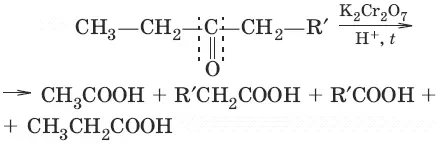
11. n CH 2=O → (—CH2—O—) n параформ n = 8—12 (полимеризация)
11. Карбоновые кислоты и их производные
Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп —COOH, связанных с углеводородным радикалом. По числу карбоксильных групп кислоты подразделяются на: одноосновные (монокарбоновые) CH 3COOH (уксусная), многоосновные (дикарбоновые, трикарбоновые и т. д.). По характеру углеводородного радикала различают кислоты: предельные (например, CH 3CH 2CH 2COOH); непредельные (CH 2=CH(—COOH); ароматические (С 6Н 5COOH).
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса –оваяи слова «кислота»: HCOOH – метановая (муравьиная) кислота, CH 3COOH – этановая (уксусная) кислота. Для карбоновых кислот характерная структурная изомерия: а) изомерия скелета в углеводородном радикале (начиная с С 4); б) межклассовая изомерия, начиная с С 2. Возможна цис-транс-изомерия в случае непредельных карбоновых кислот. Электронная плотность π - связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создается недостаток электронной плотности, и он притягивает к себе неподеленные пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О—Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.
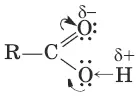
В водном растворе карбоновые кислоты диссоциируют на ионы:
R—COOH ↔ R—COО¯ + Н +
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
Способы получения карбоновых кислот
1. CH 3—СCl 3+ 3NaOH → CH 3—COOH + 3NaCl + Н 2O (гидролиз тригалогенопроизводных)
2. R—CHO + [О] → R—COOH (окисление альдегидов и кетонов)
3. CH 3—CH=CH 2+ CO + Н 2O/Н +→ Ni, р, t → CH 3—CH 2—CH 2—COOH (оксосинтез)
4. CH 3C≡N + 2Н 2O/ Н + → CH 3COOH + NH 4(гидролиз нитрилов)
5. CO + NaOH → HCOONa; 2HCOONa + H 2SO 4 → 2HCOOH + Na 2SO 4(получение HCOOH)
Химические свойства карбоновых кислот и их производных
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами, образуя разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, гало-генангидриды.
1. а) 2CH 3COOH + Fe → (CH 3COO) 2Fe + Н 2(образование солей)
б) 2CH 3COOH + MgO → (CH 3COO) 2Mg + Н 2O
в) CH 3COOH + KOH → CH 3COОК + Н 2O
г) CH 3COOH + NaHCO 3 → CH 3COONa + CO 2+ Н 2O
CH 3COONa + H 2O ↔ CH 3COOH + NaOH (соли карбоновых кислот гидролизуются)
2. (образование вложных эфиров)
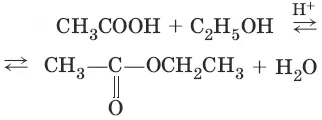
(омыление вложного эфира)
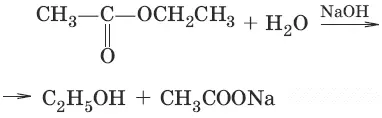
3. (получение хлорангидридов кислот)
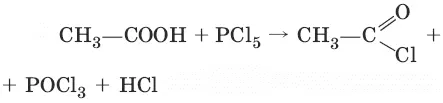
4. (разложение водой)
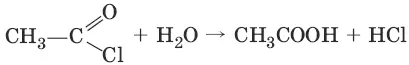
5. CH 3—COOH + Cl 2 → hv → Cl—CH 2—COOH + HCl (галогенирование в α-положение)
6. HO—CH=O + Ag 2O → NH 3 → 2Ag + Н 2CO 3(Н 2O + CO 2) (особенности HCOOH)
HCOOH → t → CO + Н 2O
Жиры– сложные эфиры глицерина и высших одноатомных карбоновых кислот. Общее название таких соединений – триглицериды. В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой С 15Н 31COOH, стеариновой С 17Н 35COOH) и ненасыщенных (олеиновой С 17Н 33COOH, линолевой С 17Н 31COOH). Жиры состоят главным образом из триглицеридов предельных кислот. Растительные жиры – масла (подсолнечное, соевое) – жидкости. В состав триглицеридов масел входят остатки непредельных кислот.
Читать дальше
Конец ознакомительного отрывка
Купить книгу



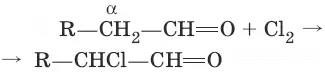

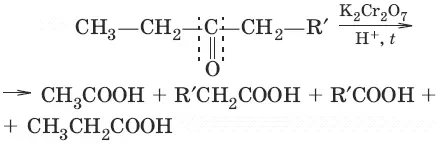

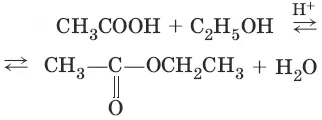
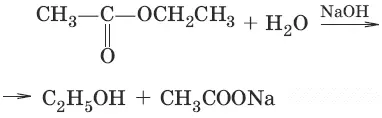
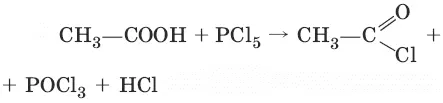
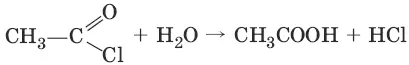







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



