Способы получения спиртов
1. CH 2=CH 2+ Н 2O/Н + → CH 3—CH 2OH (гидратация алкенов)
2. CH 3—CHO + Н 2→ t, Ni → С 2Н 5OH (восстановление альдегидов и кетонов)
3. C 2H 5Br + NaOH (водн.) → С 2Н 5OH + NaBr (гидролиз галогенопроизводных)
ClCH 2—CH 2Cl + 2NaOH (водн.) → HOCH 2—CH 2OH + 2NaCl
4. CO + 2Н 2→ ZnO, CuO, 250 °C, 7 МПа → CH 3OH (получение метанола, промышленность)
5. С 6Н 12O 6→ дрожжи → 2С 2Н 5OH + 2CO 2(брожение моноз)
6. 3CH 2=CH 2+ 2KMnO 4+ 4Н 2O → 3CH 2OH—CH 2OH - этиленгиликоль + 2KOH + 2MnO 2(окисление в мягких условиях)
7. а) CH 2=CH—CH 3+ O 2→ CH 2=CH—CHO + Н 2O
б) CH 2=CH—CHO + Н 2→ CH 2=CH—CH 2OH
в) CH 2=CH—CH 2OH + Н 2O 2→ HOCH 2—CH(OH)—CH 2OH (получение глицерина)
Химические свойства спиртов
Химические свойства спиртов связаны с наличием в их молекулу группы —OH. Для спиртов характерны два типа реакций: разрыв связи С—О и связи О—Н.
1. 2С 2Н 5OH + 2Na → Н 2+ 2C 2H 5ONa (образование алкоголятов металлов Na, К, Mg, Al)
2. а) С 2Н 5OH + NaOH ≠ (в водном растворе не идет)
б) CH 2OH—CH 2OH + 2NaOH → NaOCH 2—CH 2ONa + 2Н 2O
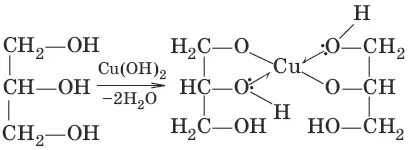
в) (качественная реакция на многоатомные спирты – образование ярко-синего раствора с гидроксидом меди)
3. а) (образование сложных эфиров)
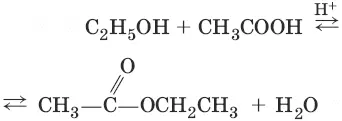
б) С 2Н 5OH + H 2SO 4 → С 2Н 5—О—SO 3H + Н 2O (на холоду)
в)
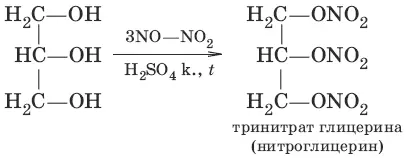
4. а) С 2Н 5OH + HBr → С 2Н 5Br + Н 2O
б) С 2Н 5OH + РCl 5 → С 2Н 5Cl + POCl 3+ HCl
в) С 2Н 5OH + SOCl 2 → С 2Н 5Cl + SO 2+ HCl (замещение гидроксильной группы на галоген)
5. С 2Н 5OH + HOC 2H 5→ H 2SO 4, <140 °C → C 2H 5—O—C 2H 5+ H 2O (межмолекулярная гидротация)
6. С 2Н 5OH → H 2SO 4, 170 °C → CH 2=CH 2+ H 2O (внутримолекулярная гидротация)
7. а) (дегидрирование, окисление первичных спиртов)
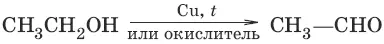
б) (дегидрирование, окисление вторичных спиртов)
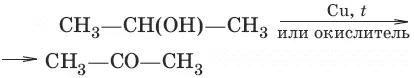
Фенолами называются производные аренов, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы. По числу гидроксильных групп в ароматическом кольце различают одно– и многоатомные (двух– и трехатомные) фенолы. Для большинства фенолов используются тривиальные названия. Структурная изомерия фенолов связана с различным положением гидроксильных групп.
Способы получения фенолов
1. С 6Н 5Cl + NaOH(p, 340°C) → С 6Н 5OH + NaCl (щелочной гидролиз галогеноуглеводородов)
2. (кумольный способ получения)
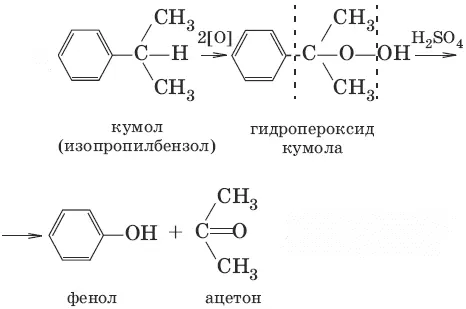
3. C 6H 5SO 3Na + NaOH (300–350°C) → С 6Н 5OH + Na 2SO 3(щелочное плавление солей ароматических сульфоновых кислот)
Химические свойства фенолов
Фенолы в большинстве реакций по связи О—Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие непо-деленной электронной пары атома кислорода в системе л-сопряжения). Кислотность фенолов значительно выше, чем спиртов.
Для фенолов реакции разрыва связи С—О не характерны. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра.
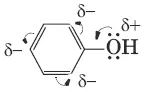
Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно в орто– и пара- положениях (+М-эффект OH-группы). Для обнаружения фенолов используется качественная реакция с хлоридом железа(III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
1. 2С 6Н 5OH + 2Na → 2C 6H 5ONa + Н 2(так же, как и этанол)
2. С 6Н 5OH + NaOH → C 6H 5ONa + H 2O (в отличие от этанола)
C 6H 5ONa + Н 2O + CO 2 → С 6Н 5OH + NaHCO 3(фенол более слабая кислота, чем угольная)
3.
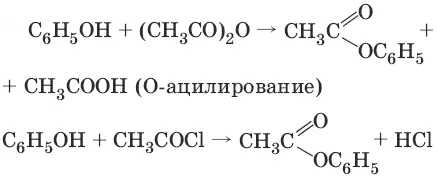
Фенолы не образуют сложные эфиры в реакциях с кислотами. Для этого используются более реакционноспособные производные кислот (ангидриды, хлорангидриды).
Читать дальше
Конец ознакомительного отрывка
Купить книгу


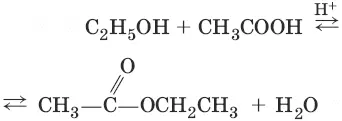
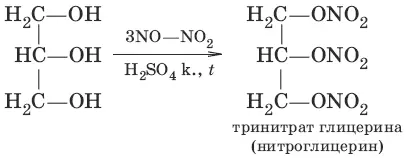
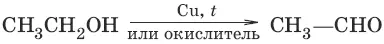
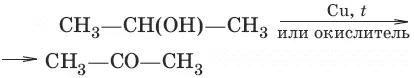



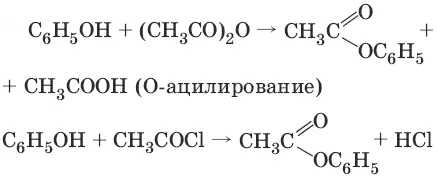







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



