4. С 6Н 5OH + CH 3CH 2OH → NaOH → С 6Н 5OCH 2CH 3+ NaBr (О-алкилирование)
5.
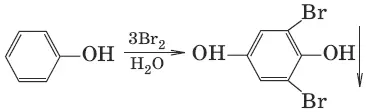
(взаимодействие с бромной водой, качественная реакция)
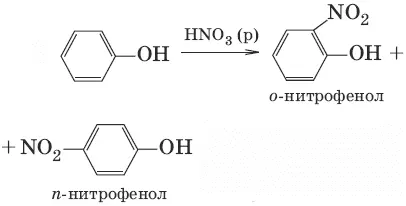
6.(нитрование разб. HNO 3, при нитрировании конц. HNO 3образуется 2,4,6-тринитрофенол)
7. n C 6H 5OH + n CH 2O → n H 2O + (—C 6H 3OH—CH 2—) n (поликонденсация, получение фенолформальдегидных смол)
Альдегидами называются соединения, в которых карбонильная группа
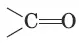
соединена с углеводородным радикалом и атомом водорода, а кетонами – карбонильные соединения с двумя углеводородными радикалами.
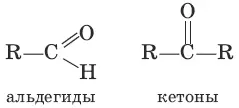
Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса –аль. Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении: Н 2С=O – метаналь (муравьиный альдегид, формальдегид); CH 3CH=O – этаналь (уксусный альдегид). Систематические названия кетонов несложного строения производят от названий радикалов с добавлением слова «кетон». В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса –он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе. Примеры: CH 3—CO—CH 3– диметилкетон (пропанон, ацетон). Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов: а) изомерия углеродного скелета, начиная с С 4; б) межклассовая изомерия. Изомерия кетонов: а) углеродного скелета (с С 5); б) положения карбонильной группы (с С 5); в) межклассовая изомерия.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp 2- гибридизации. Связь С=O сильно полярна. Электроны кратной связи С=O смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда, а карбонильный атом углерода приобретает частичный положительный заряд.
Способы получения альдегидов и кетонов
1. а) (дегидрирование, окисление первичных спиртов)
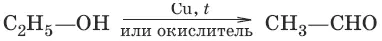
б) (дегидрирование, окисление вторичных спиртов)
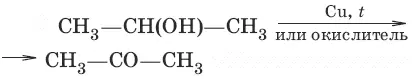
2. а) CH 3CH 2CHCl 2+ 2NaOH → в воде → CH 3CH 2CHO + 2NaCl + H 2O (гидролиз дигалогенопроизводных)
б) CH 3СCl 2CH 3+ 2NaOH → в воде → CH 3COCH 3+ 2NaCl + H 2O
3. (гидратация алкинов, реакция Кучерова)
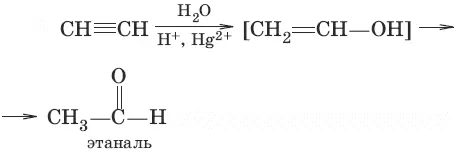
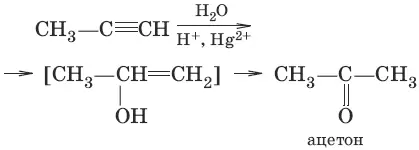
4. (окисление этилена до этаналя)
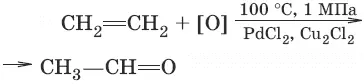
(окисление метана до формальдегида)
CH 4+ O 2→ 400–600 °C, NO → H 2C=O + H 2O
Химические свойства альдегидов и ке-тонов
Для карбонильных соединений характерны реакции различных типов: а) присоединение по карбонильной группе; б) восстановление и окисление; в) конденсация; д) полимеризация.
1. (присоединение циановодородной кислоты, образование гидроксинитрилов)
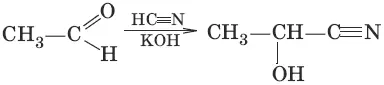
2. (присоединение гидросулбфита натрия)
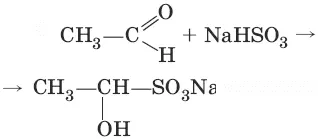
3. (восстановление)
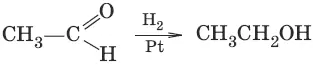
4. (образование полуацеталец и ацеталей)
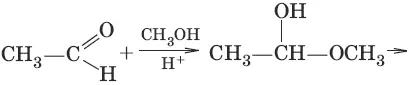
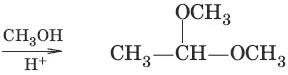
5. (взаимодействие с гидроксоламином, образование оксима ацетальдегида)
Читать дальше
Конец ознакомительного отрывка
Купить книгу

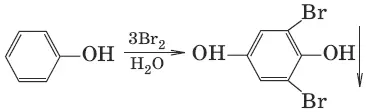

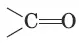

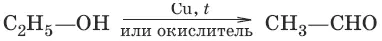
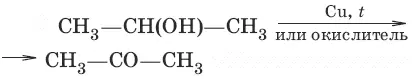
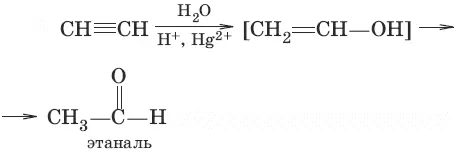
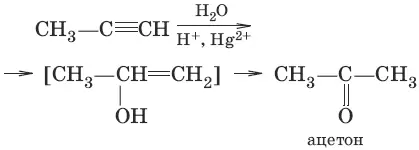
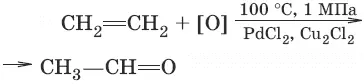
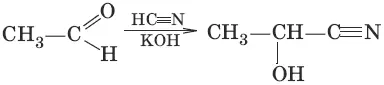

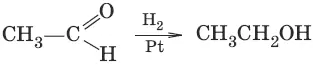
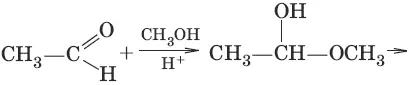
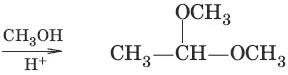







![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



