в) R 2NH + Н—О—N=O → R 2N—N=O (N-нитрозамин) + Н 2O (вторичные жирные и ароматические амины)
г) R 3N + Н—О—N=O → при низкой температуре нет реакции (третичные жирные амины)
д)
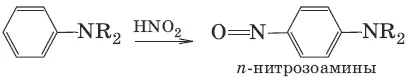
(третичные ароматические амины)
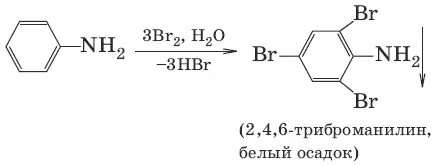
Свойства анилина. Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и аммиаком, но под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения по сравнению с бензолом.
C 6H 5—NH 2+ HCl → [C 6H 5—NH 3]Cl = C 6H 5NH 2 • HCl
C 6H 5NH 2• HCl + NaOH → C 6H 5NH 2+ NaCl + H 2O
C 6H 5NH 2+ CH3I → t → [C 6H 5NH 2CH 3] +I¯
Аминокислотами называются гетеро-функциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу. В зависимости от взаимного расположения амино– и карбоксильной групп аминокислоты подразделяют на α-, β-, γ– и т. д. По ИЮПАК, для наименования аминокислот группу NH 2— называют приставкой амино-,указывая цифрой номер углеродного атома, с которым она связана, а затем следует название соответствующей кислоты.
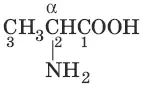
2-аминопропановая кислота (α-аминопропановая, α-аланин)
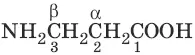
3-аминопропановая кислота (β-аминопропановая, β-аланин)
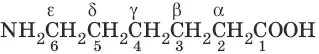
6-аминогексановая кислота (ε-аминокапроновая)
По характеру углеводородного радикала различают алифатические (жирные) и ароматические аминокислоты. Изомерия аминокислот зависит от строения углеродного скелета, положения аминогруппы по отношению к карбоксильной группе. Для аминокислот характерна еще оптическая изомерия.
Способы получения аминокислот
1. (аммонолиз галогенокислот)
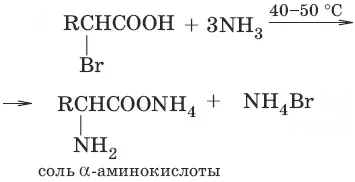
2. CH 2=CH—COOH + NH 3 → H 2N—CH 2—CH 2—COOH (присоединение аммиака к α, β-непредельным кислотам)
3.
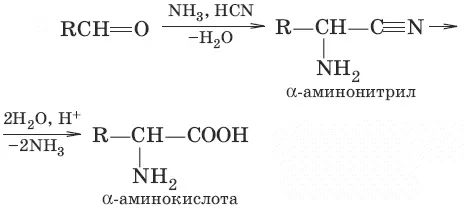
(действие HCN и NH 3на альдегиды или кетоны)
4. Гидролиз белков под влиянием ферментов, кислот или щелочей.
5. Микробиологический синтез.
Химические свойства аминокислот
Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т. е. являются амфотерными соединениями. В кристаллическом состоянии и в среде, близкой к нейтральной, аминокислоты существуют в виде внутренней соли – дипо-лярного иона, называемого также цвиттер-ион H 3N +—CH 2—COO¯.
1. H 2N—CH 2—COOH + HCl → [H 3N +—CH 2—COOH]Cl¯ (образование солей по аминогруппе)
2. H 2N—CH 2—COOH + NaOH → H 2N—CH 2—COO¯Na ++ H 2O (образование солей)
3.
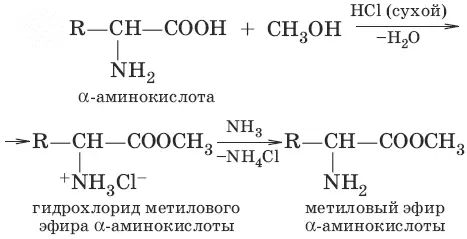
(образование сложного эфира)
4.
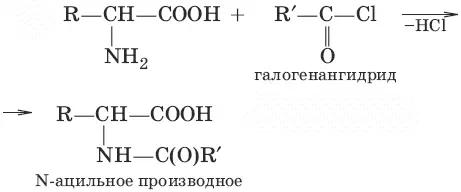
(ацилирование)
5. +NH 3—CH 2—COO¯ + 3CH 3I → —HI → (CH 3) 3N +—CH 2—COO¯ – бетаин аминоуксусной кислоты
(алкилирование)
6.
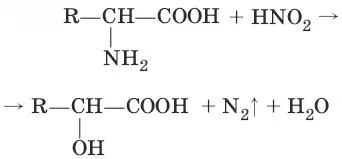
(взаимодействие с азотистой кислотой)
7. n H 2N—(CH 2) 5—COOH → (—HN—(CH 2) 5—CO—) n + n H 2O (получение капрона)
15. Углеводы. Моносахариды. Олигосахариды. Полисахариды
Углеводы (сахара) – органические соединения, имеющие сходное строение и свойства, состав большинства которых отражает формула С х(Н 2O) y, где х, у ≥ 3.
Классификация:
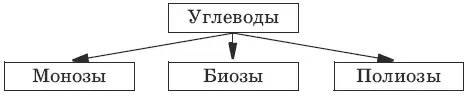
Моносахариды не гидролизуются с образованием более простых углеводов. Олиго-и полисахариды расщепляются при кислом гидролизе до моносахаридов. Общеизвестные представители: глюкоза (виноградный сахар) С 6Н 12O 6, сахароза (тростниковый, свекловичный сахар) С 12Н 22О 11, крахмал и целлюлоза [С 6Н 10О 5] n.
Читать дальше
Конец ознакомительного отрывка
Купить книгу


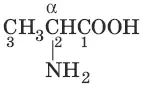
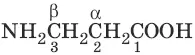
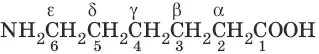
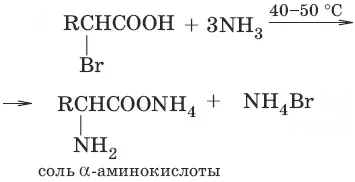

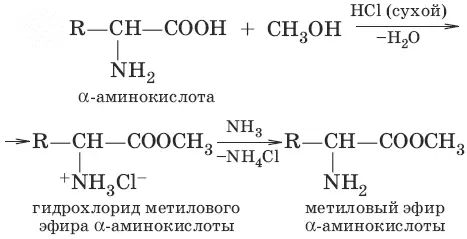
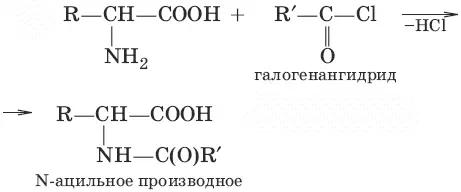
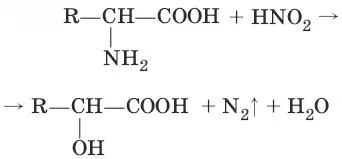








![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



