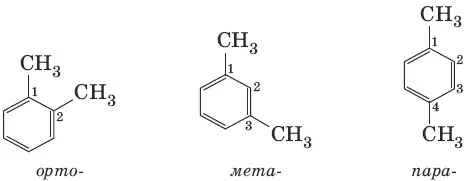
Виды изомерии (структурная): 1) положения заместителей для ди-, три– и тетра-замещенных бензолов (например, о-, м- и п -ксилолы); 2) углеродного скелета в боковой цепи, содержащей не менее 3 атомов углерода; 3) заместителей (R), начиная с R=С 2Н 5.
Способы получения ароматических углеводородов
1. С 6Н 12 → Pt, 300 °C → С 6Н 6+ ЗН 2(дегидрирование циклоалканов)
2. н- С 6Н 14→ Cr 2O 3, 300 °C → С 6Н 6+ 4Н 2(дегидроциклизация алканов)
3. ЗС 2Н 2→ С, 600 °C → С 6Н 6(циклотримеризация ацетилена, реакция Зелинского)
Химические свойства ароматических углеводородов
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы, а именно реакции замещения атомов водорода, связанных с циклом. Другие реакции (присоединение, окисление), в которых участвуют делокали-зованные С-С связи бензольного кольца и нарушается его ароматичность, идут с трудом.
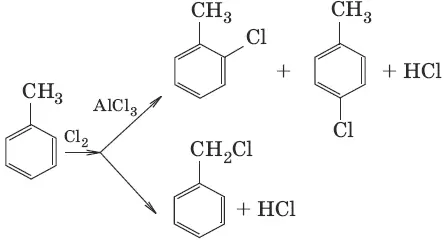
1. C 6H 6+ Cl 2→ AlCl 3 → C 6H 5Cl + HCl (галогенирование)
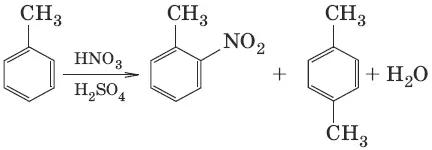
2. C 6H 6+ HNO 3→ H 2SO 4 → C 6H 5—NO 2+ H 2O (нитрование)
3. С 6Н 6→ H 2SO 4 → С 6Н 5—SO 3H + H 2O (сульфирование)
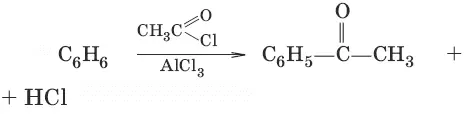
4. С 6Н 6+ RCl → AlCl 3 → С 6Н 5—R + HCl (алкилирование)
5. (ацилирование)
6. С 6Н 6+ ЗН 2→ t, Ni → С 6Н 12циклогексан (присоединение водорода)
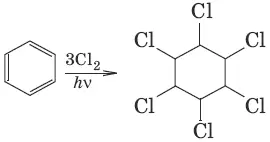
7. (1,2,3,4,5,6-гексахлороциклогексан, присоединение хлора)
8. С 6Н 5—CH 3+ [О] → С 6Н 5—COOH кипячение с раствором КMnO 4(окисление алкилбензолов)
Галогеноуглеводородами называются производные углеводородов, в которых один или несколько атомов водорода заменены на атомы галогена.
Способы получения галогеноуглеводородов
1. CH 2=CH 2+ HBr → CH 3—CH 2Br (гидрогалогенирование ненасыщенных углеводородов)
CH≡CH + HCl → CH 2=CHCl
2. CH 3CH 2OH + РCl 5 → CH 3CH 2Cl + POCl 3+ HCl (получение из спиртов)
CH 3CH 2OH + HCl → CH 3CH 2Cl + Н 2O (в присутствии ZnCl 2, t°C )
3. а) CH 4+ Cl 2 →hv→ CH 3Cl + HCl (галогенирование углеводородов)
б)
Химические свойства галогеноуглево-дородов
Наибольшее значение для соединений этого класса имеют реакции замещения и отщепления.
1. CH 3CH 2Br + NaOH (водн. р-р) → CH 3CH 2OH + NaBr (образование спиртов)
2. CH 3CH 2Br + NaCN → CH 3CH 2CN + NaBr (образование нитрилов)
3. CH 3CH 2Br + NH 3→ [CH 3CH 2NH 3] +Br ↔— HBr ↔ CH 3CH 2NH 2(образование аминов)
4. CH 3CH 2Br + NaNO 2 → CH 3CH 2NO 2+ NaBr (образование нитросоединений)
5. CH 3Br + 2Na + CH 3Br → CH 3—CH 3+ 2NaBr (реакция Вюрца)
6. CH 3Br + Mg → CH 3MgBr (образование магнийорганических соединений, реактив Гриньяра)
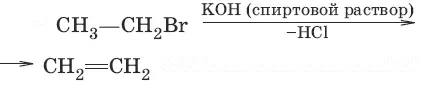
7. (дегидрогалогенирование)
Спиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (—OH), связанных с насыщенными атомами углерода. Группа —OH (гидроксильная, оксигруппа) является в молекуле спирта функциональной группой. Систематические названия даются по названию углеводорода с добавлением суффикса - оли цифры, указывающей положение гидроксигруппы. Нумерация ведется от ближайшего к OH-группе конца цепи.
По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа —OH), многоатомные (две и более групп —OH). Одноатомные спирты: метанол CH 3OH, этанол С 2Н 5OH; двухатомный спирт: этилен-гликоль (этандиол-1,2) HO—CH 2—CH 2—OH; трехатомный спирт: глицерин (пропантриол-1,2,3) HO—CH 2—CH(OH)—CH 2—OH. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты первичные R—CH 2—OH, вторичные R 2CH—OH, третичные R 3C—OH.
По строению радикалов, связанных с атомом кислорода, спирты подразделяются на предельные, или алканолы (CH 3CH 2—OH), непредельные, или алкенолы (CH 2=CH—CH 2—OH), ароматические (С 6Н 5CH 2—OH).
Виды изомерии (структурная изомерия): 1) изомерия положения OH-группы (начиная с С 3); 2) углеродного скелета (начиная с С 4); 3) межклассовая изомерия с простыми эфирами (например, этиловый спирт CH 3CH 2OH и диметиловый эфир CH 3—О—CH 3). Следствием полярности связи О—Н и наличия неподеленных пар электронов на атоме кислорода является способность спиртов к образованию водородных связей.
Читать дальше
Конец ознакомительного отрывка
Купить книгу














![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/385781/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres-thumb.webp)



