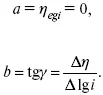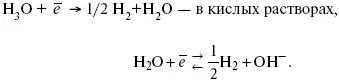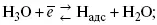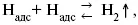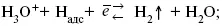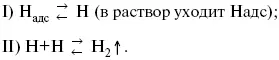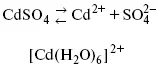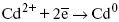η = a + b ln i – уравнение Тафеля в простом виде при замедлении стадии переноса заряда.
Величина i 0(тока обмена) и α (коэффициента переноса) – основные кинетические параметры стадии переноса заряда (q). Они могут быть определены из экспериментальных измерений, для этого на исследуемом электроде снимают зависимость η– i или E i– i.
Поляризационная кривая судит о коррозионной стойкости металлов.
Перестраиваем поляризационную кривую в координаты:
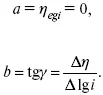
Определяем const а и b в уравнении Тафеля, определяем b:
Из коэффициента b найдем а, после подставим в а и найдем i 0.
Перенапряжение Н 2(водорода).
Источник выделения Н 2– Н 2SO 4 →Н ++ НSO 4 –
Источник выделения Н 2– Н 2О →Н ++ ОН -.
В рН < 7 Н 2выделяется по реакции.
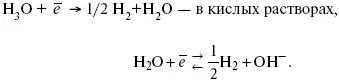
Н 2всегда выделяется в потенциалах более отрицательных, чем равновесный потенциал, то есть с перенапряжением.
Суммарный процесс выделения водорода состоит из следующих стадий:
1) доставка к поверхности катода реагирующих частиц Н 3О +;
2) разряд Н 3О +с образованием Н адс
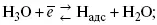
3) удаление выделяющегося Н адсс поверхности электрода может происходить тремя путями:
а) каталитическая рекомбинация
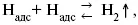
где К at – материал катода;
б) электрохимическая десорбция – удаление Н 2происходит на уже адсорбированных атомах
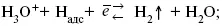
в) эмиссия включает две стадии:
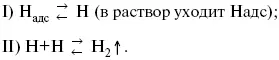
Для Pt замедлена стадия а), для других металлов (Hg, Pb) – стадия разряда, Н +– самый подвижный.
3. Кинетические особенности электроосаждения металлов и сплавов
Процесс электроосаждения металлов, сплавов протекает через последовательность стадий: диффузия катионов металлов к поверхности электрода из объема раствора, вхождение катионов в ДЭС (двойной электрический слой), потери сольватной оболочки, переход катионов в состояние адсорбции атома, полный перенос заряда с поверхности электрода на разряжающийся ион или адсорбированного атома (ад. атома) и образование зародышей металлов, рост зародышей и заполнение поверхности новой фазы в виде сплошного слоя, рост слоя осадка в толщину.
Процесс электровыделения не зависит от состояния поверхности электрода, в частности, большое влияние на η (перенапряжение) процесса оказывает концентрация вакансий на поверхности электрода. Кристаллическая решетка каждого металла содержит определенное количество равновесных вакансий (свободных незанятых узлов в кристаллической решетке). Наличие таких пустот в структуре поверхностного слоя облегчает образование ад.атомов, так как в местах вакансий имеет место более сильное энергетическое воздействие кристаллической решетки на образующиеся атомы новой фазы. После заполнения этих активных мест начинается рост зародышей, т. е. образование скоплений атомов, которые постепенно заполняют всю поверхность. С другой стороны, скорость реакции электровыделения металлов зависит от состояния катионов этого металла в растворе. В растворе катионы находятся в сольватированном виде или в виде комплексов. Разрушение сольватной оболочки происходит на границе плотного слоя Гельмгольца с диффузной частью ДЭС. Таким образом, реакции разряда, протекающие в плотном слое Гельмгольца, энергетически возможны только в том случае, если ионы металла преодолевают потенциальный барьер. Высота потенциального барьера, т. е. величина энергии, которую ионам в растворе нужно преодолеть, чтобы попасть из раствора в плотный слой Гельмгольца, может быть различной, и определяется она природой растворителя, лигандов, прочностью связей в комплексах.
Пример:
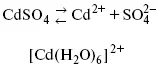
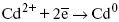
(заряд комплекса не меняется, так как молекула нейтральна).
Читать дальше
Конец ознакомительного отрывка
Купить книгу