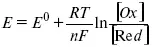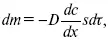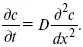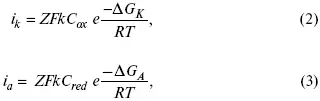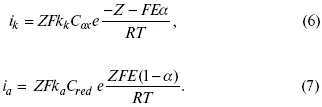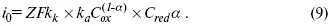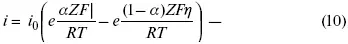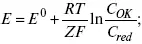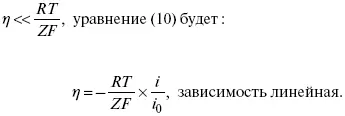Законы Фарадея– основные законы электролиза, согласно которых, количество вещества, выделившегося при электролизе, прямо пропорционально его химическому эквиваленту и количеству прошедшего электричества.
Уравнение Нернста
Е 0– равновесный стандартный потенциал.

где С 0– стандартная концентрация раствора;
С – любая концентрация в нестандартных условиях, С = С 0x Е = Е 0, т. е. в стандартных условиях С = C 0= 1 моль.
Для окислительных веществ
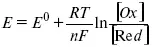
1-й закон Фика:
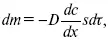
где dc/dx – градиент концентрации;
s – площадь, через которую происходит диффузия.
Δ – коэффициент диффузии cм 2x c -1, показывает число частиц, продиффундировавших за 1 с через поперечное сечение раствора площадью 1 см 2, dt – время диффузии, dm – число продиффундировавших частиц.

где Т к– коэффициент внутреннего трения;
D – коэффициент диффузии.
Первый закон Фика относится к процессу стационарной диффузии, сходен с закономерностями переноса тепла из электричества.
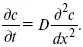
Если диффузионный поток не изменяется с течением времени, это называется стационарной диффузией.
Диффузия– самопроизвольно протекающий в системе процесс выравнивания концентрации молекул, ионов, частиц под влиянием теплового хаотического движения.
Основное уравнение электрохимической кинетики
i k= i a= i 0,
где i 0– ток обмена,

(окислительно-восстановительные реакции).
При катодной поляризации на электроде через систему протекает i k преимущественно, если поляризация не слишком велика, то суммарная скорость процесса равна:
i = i k– i a,
для реакции (1) катодные и анодные токи будут равны:
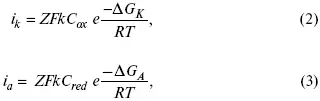
где Z – количество электронов, участвующих в реакции;
F – число Фарадея;
к – const скорости;
С ox, C red– концентрация окислительной и восстановленной форм реагентов;
Δ G K– энергия активации катодного процесса;
Δ G A– энергия активации анодного процесса.
Энергия активации зависит от величины накладываемого потенциала, в то же самое время эта энергия распределяется между прямой и обратной реакцией в соответствии с коэффициентом переноса – а, т. е.
υ = υ пр– υ об.
Коэффициент переноса α – доля энергии электрического поля в ДЭС, которая приходится на прямую и обратную реакции.
α– коэффициент переноса для катодной реакции;
(1 – α) – для анодного процесса (коэффициент переноса).
ΔG k = ZFE α, (4)
Δ GA = ZFE(1 – α) (5)
С учетом уравнений (4), (5) уравнения (2), (3) примут следующий вид:
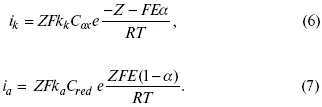
Различие знаков у электрона объясняется тем, что катодная поляризация («–») ускоряет прямую реакцию и замедляет обратную реакцию.

Введем в уравнение (8) плотность тока обмена – i 0.
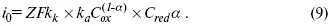
Вместо потенциала введем перенапряжение:
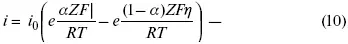
полное уравнение поляризационной кривой.
Вывод из уравнения (10):
1) при равновесном потенциале, когда ток равен нулю, уравнение (10) преобразуется в уравнение Нернста:
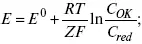
2) при малых величинах η:
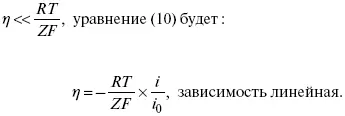
При сдвижении потенциала от равновесного (59 m В);
Читать дальше
Конец ознакомительного отрывка
Купить книгу